题目内容
(一)BaCl2·xH2O中结晶水数目可通过重量法来确定:
①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;
②过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g。
回答下列问题:
(1)在操作②中,需要先后用稀硫酸和 洗涤沉淀;
(2)计算BaCl2·xH2O中的x= (取整数值)。
(3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果 (填“偏低”、“偏高”或“不变”)。
(二)、(5分)图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞
如图B所示。且该物质为自然界最硬的物质。

回答下列问题:
(1)图B对应的物质名称是 ,(2)d中元素的原子核外电子排布式为 。
(3)图A中由二种元素组成的物质中,沸点最高的是 ,
(4)图A中的双原子分子中,极性最大的分子是 。
(5)k的分子式为 ,
①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;
②过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g。
回答下列问题:
(1)在操作②中,需要先后用稀硫酸和 洗涤沉淀;
(2)计算BaCl2·xH2O中的x= (取整数值)。
(3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果 (填“偏低”、“偏高”或“不变”)。
(二)、(5分)图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞
如图B所示。且该物质为自然界最硬的物质。

回答下列问题:
(1)图B对应的物质名称是 ,(2)d中元素的原子核外电子排布式为 。
(3)图A中由二种元素组成的物质中,沸点最高的是 ,
(4)图A中的双原子分子中,极性最大的分子是 。
(5)k的分子式为 ,
(一)(1)蒸馏水 取水洗液于试管中,加入稀硝酸酸化,滴加AgNO3溶液,若无白色浑浊出现,则表明Cl-已经冼净。 (2) 2 (3)偏高。
(二)(1)金刚石 (2)1s22s22p63s23p5 (3)H2O (4)HCl (5)COCl2
(二)(1)金刚石 (2)1s22s22p63s23p5 (3)H2O (4)HCl (5)COCl2
试题分析:
(一)(1)洗涤必须用到蒸馏水
(2)样品中BaCl2的物质的量为
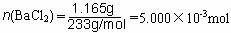
质量
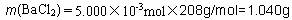
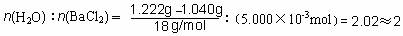
(3)题中已经表明硫酸钡被还原为BaS,则沉淀质量减小,相对水的质量比提高,x数据将偏高。
(二)(1)每个a原子周围有4个键,则图B对应的物质为金刚石;该晶胞中的原子数为:8×
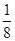 +6×
+6×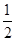 =4=8。
=4=8。(2)a为C,则b为H2、c为O2,因i是常见的酸,只由b、d形成可判断为盐酸,则d为Cl2。Cl原子核外有17个电子,其排布式为:1s22s22p63s23p5。
(3)除a、b、c、d外,f为CO,g为CO2,i为HCl,而k与水反应生成CO2与盐酸,判断K为COCl2。所有两元素形成的物质中,只有水是液态,其它都是气体;H2O中,中心原子O形成2条共价键、2对孤对电子,故O采取sp3杂化,形成V形分子。
(4)所有双原子分子中,只有H、Cl电负性差值最大,因而极性最大。(5)COCl2中C原子含有3个σ键,1个π键,故C原子采取sp2杂化。

练习册系列答案
相关题目



 在过量氨水中易转化为
在过量氨水中易转化为 。写出
。写出 的价层电子排布图____。
的价层电子排布图____。 中
中 的配位数为____:NH3分子的中心原子杂化方式为____。
的配位数为____:NH3分子的中心原子杂化方式为____。 等。CO与N2属于等电子体,则CO分子中
等。CO与N2属于等电子体,则CO分子中 键和
键和 键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。
键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。 O.该晶体中Ni3+与Ni2+的离子数之比为____。
O.该晶体中Ni3+与Ni2+的离子数之比为____。

