题目内容
我国已研制出一种稀土制冷材料,其主要成分是LaCaMnO。
(1)锰原子的基态价层电子排布式为________。
(2)S与O为同主族元素,其中电负性较大的是________;H2S分子中S原子杂化轨道类型为________;试从结构角度解释H2SO4的酸性大于H2SO3的酸性:____________。
(3)Ca在空气中点燃生成CaO和少量Ca2N2。
①Ca2N2和水反应可以生成NH2—NH2,NH2—NH2能否作配体?________(填“能”或“否”)。
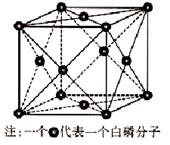
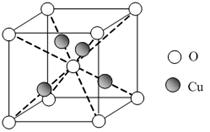
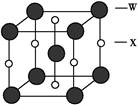
②CaO晶体与NaCl晶体一样,为面心立方最密堆积,则一个CaO晶胞中含有Ca2+数为________;欲比较CaO与NaCl的晶格能大小,需考虑的数据是________。
(1)锰原子的基态价层电子排布式为________。
(2)S与O为同主族元素,其中电负性较大的是________;H2S分子中S原子杂化轨道类型为________;试从结构角度解释H2SO4的酸性大于H2SO3的酸性:____________。
(3)Ca在空气中点燃生成CaO和少量Ca2N2。
①Ca2N2和水反应可以生成NH2—NH2,NH2—NH2能否作配体?________(填“能”或“否”)。
②CaO晶体与NaCl晶体一样,为面心立方最密堆积,则一个CaO晶胞中含有Ca2+数为________;欲比较CaO与NaCl的晶格能大小,需考虑的数据是________。
(1)3d54s2
(2)O sp3 H2SO4的非羟基氧原子数目大于H2SO3
(3)①能 ②4 Ca2+、O2-与Na+、Cl-的离子半径与离子所带的电荷数
(2)O sp3 H2SO4的非羟基氧原子数目大于H2SO3
(3)①能 ②4 Ca2+、O2-与Na+、Cl-的离子半径与离子所带的电荷数
(1)Mn位于周期表第四周期第ⅦB族,其基态价层电子排布式为3d54s2。(2)O的电负性较大;H2S中心原子S上有两对孤电子对,H2S分子中S原子杂化轨道类型为sp3杂化;H2SO3和H2SO4可表示成(HO)2SO和(HO)2SO2,H2SO4的非羟基氧原子数目大于H2SO3,故H2SO4的酸性大于H2SO3的酸性。(3)①由于H2N—NH2中的氮原子上有孤电子对可以作为配体和其他离子形成配合物。②由NaCl的晶胞结构可知一个CaO晶胞中含有4个Ca2+;晶格能的大小与离子半径和离子所带的电荷数有关。

练习册系列答案
相关题目
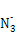 与X、Y形成的一种化合物互为等电子体,则
与X、Y形成的一种化合物互为等电子体,则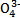 的立体构型为 。
的立体构型为 。