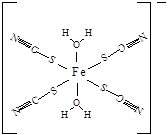题目内容
从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质.
(1)下列说法正确的是 (填字母).
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为 .光气(COCl2)各原子最外层都满足8电子稳定结构,COCl2分子空间构型为 (用文字描述).
(3)Cu 2+基态的电子排布式为 .向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为 ,不考虑空间构型,其内界结构可用示意图表示为 .

(1)下列说法正确的是 (填字母).
| A.元素电负性由大到小的顺序为F>O>N |
| B.一个苯分子含3个π键和6个σ键 |
| C.氯化钠和氯化铯晶体中氯离子的配位数相同 |
| D.第一电离能的大小为Br>Se>As |
(3)Cu 2+基态的电子排布式为 .向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为 ,不考虑空间构型,其内界结构可用示意图表示为 .
(1)A ;(2)OCS 平面三角形
(3)1s22s22p63s23p63d9(或[Ar]3d9) sp3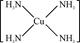
(3)1s22s22p63s23p63d9(或[Ar]3d9) sp3

(1)A.同周期自左而右电负性增大,故电负性F>O>N,故A正确;
B.苯分子中化学键是介于单键与双键之间的一种特殊化学键,故B错误;
C.氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8,故D错误;
D.同周期自左而右等于电离能呈增大趋势,但As原子4p能级有3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素,故第一电离能Br>As>Se,故D错误;
故选:A;
(2)羰基硫(OCS)与CO2为等电子体,具有CO2分子结构,故羰基硫(OCS)结构式为O=C=S,
光气(COCl2)各原子最外层都满足8电子稳定结构,C原子与氯原子之间形成C-Cl单键,C原子与O原子之间形成C=O双键,光气分子的结构式是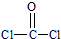 ,碳原子成3个σ键,杂化轨道数目为3,分子中C原子采取sp2杂化成键,故COCl2为平面三角形,
,碳原子成3个σ键,杂化轨道数目为3,分子中C原子采取sp2杂化成键,故COCl2为平面三角形,
故答案为:O=C=S;平面三角形;
(3)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,铜原子失去4s及3d上各一个电子形成Cu2+,故Cu2+离子的电子排布式为:1s22s22p63s23p63d9,
NH3分子中N原子成3个N-H键,含有1对孤对电子,杂化轨道数目为4,采取sp3杂化;
Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键,内界结构用示意图表示为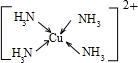 ,
,
故答案为:1s22s22p63s23p63d9;sp3;
B.苯分子中化学键是介于单键与双键之间的一种特殊化学键,故B错误;
C.氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8,故D错误;
D.同周期自左而右等于电离能呈增大趋势,但As原子4p能级有3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素,故第一电离能Br>As>Se,故D错误;
故选:A;
(2)羰基硫(OCS)与CO2为等电子体,具有CO2分子结构,故羰基硫(OCS)结构式为O=C=S,
光气(COCl2)各原子最外层都满足8电子稳定结构,C原子与氯原子之间形成C-Cl单键,C原子与O原子之间形成C=O双键,光气分子的结构式是
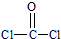 ,碳原子成3个σ键,杂化轨道数目为3,分子中C原子采取sp2杂化成键,故COCl2为平面三角形,
,碳原子成3个σ键,杂化轨道数目为3,分子中C原子采取sp2杂化成键,故COCl2为平面三角形,故答案为:O=C=S;平面三角形;
(3)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,铜原子失去4s及3d上各一个电子形成Cu2+,故Cu2+离子的电子排布式为:1s22s22p63s23p63d9,
NH3分子中N原子成3个N-H键,含有1对孤对电子,杂化轨道数目为4,采取sp3杂化;
Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键,内界结构用示意图表示为
 ,
,故答案为:1s22s22p63s23p63d9;sp3;


练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目