题目内容
11.化学与生活,社会密切相关.下列说法错误的是( )| A. | 红葡萄酒密封储存时间越长,质量越好,原因之一是贮存过程中生成了有香味的酯 | |
| B. | 透过观察颜色容易区分黄金与铜锌合金 | |
| C. | 乙烯的产量可以用来衡量一个国家的石油化工发展水平 | |
| D. | 燃料电池是一种高效、环境友好的发电装置 |
分析 A.乙醇被氧化可生成乙酸,乙酸和乙醇发生酯化反应生成具有香味的乙酸乙酯;
B.黄金与铜锌合金颜色都为黄色;
C.乙烯主要用于制造塑料、合成纤维、有机溶剂等,是石油化工发展的标志;
D.燃料电池产物为水,没有重金属离子的污染.
解答 解:A.红葡萄酒长时间密封储存,乙醇被氧化可生成乙酸,乙酸和乙醇发生酯化反应生成具有香味的乙酸乙酯,故A正确;
B.黄金与铜锌合金颜色都为黄色,可用硝酸鉴别,故B错误;
C.乙烯工业的发展,带动了其他以石油为原料的石油化工的发展.因此一个国家乙烯工业的发展水平,已成为衡量这个国家石油化学工业水平的重要标志,故C正确;
D.燃料电池可以直接将贮存在燃料与氧化剂中的化学能转化为电能,无重金属盐的污染,产物多为水、二氧化碳等,所以燃料电池是一种高效、环境友好的发电装置,故D正确.
故选B.
点评 本题考查较为综合,为高考常见题型,侧重于化学与生活、生产、环境的考查,有利于培养学生的良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
1.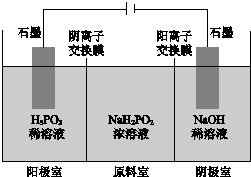 次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解
次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解
NaH2PO2制H3PO2.(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)下列说法正确的是( )
 次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解
次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解NaH2PO2制H3PO2.(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)下列说法正确的是( )
| A. | 阳极室有H2生成 | B. | 阴极室溶液pH减小 | ||
| C. | 原料室溶液pH保持不变 | D. | 阳极室可能有H3PO4生成 |
2.下列各组中的反应,属于同一反应类型的是( )
| A. | 乙烯水化制乙醇;溴乙烷水解制乙醇 | |
| B. | 甲苯使酸性高锰酸钾溶液褪色;丙炔和氢气反应制取丙烷 | |
| C. | 甲苯硝化制TNT;乙炔与氯化氢反应制氯乙烯 | |
| D. | 乙醇脱水制乙烯;溴乙烷脱溴化氢制乙烯 |
19.下列各组有机物,不论以何种比值混合,只要二者物质的量之和不变,完全燃烧时所消耗的氧气的物质的量和生成的水的物质的量分别相等的是( )
| A. | 甲烷和乙醇 | B. | 乙烷和乙醇 | C. | 苯和苯甲酸 | D. | 乙炔和苯 |
6.下列说法正确的是( )
| A. | 第IA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈 | |
| B. | 第二周期元素的最高正价和最低负价的绝对值之和等于8 | |
| C. | 同周期主族元素的原子形成简单离子的电子层结构相同 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
16.甲、乙两种非金属:
①甲比乙容易与H2化合;
②甲原子能与乙阴离子发生置换反应;
③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;
④与某金属反应时,甲原子得电子数目比乙的多;
⑤甲的单质熔、沸点比乙的低.
能说明甲比乙的非金属性强的是( )
①甲比乙容易与H2化合;
②甲原子能与乙阴离子发生置换反应;
③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;
④与某金属反应时,甲原子得电子数目比乙的多;
⑤甲的单质熔、沸点比乙的低.
能说明甲比乙的非金属性强的是( )
| A. | 只有④ | B. | 只有⑤ | C. | ①②③ | D. | ①②③④ |
3.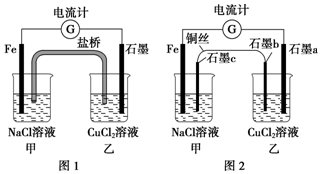 将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )
将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )
 将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )
将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )| A. | 图2中电流计指针偏转方向与图1中相同 | |
| B. | 图2中石墨a上有铜生成 | |
| C. | 向图2中甲装置石墨c附近滴加酚酞试液,出现红色 | |
| D. | 图2中电子流向为Fe→电流计→石墨a→石墨b→铜丝→石墨c→Fe |
20.下列有关叙述不正确的是( )
①在100℃,101KPa条件下,液态水气化热为40.69KJ•mol-1.则H2O(g)=H2O(l) H=+40.69KJ•mol-1
②已知25℃时,MgCO3的Ksp=6.82×10-6,则在该温度下,含有固体MgCO3的溶液中,无论c(Mg2+)与c(CO32-)是否相等,总有c(Mg2+)•c(CO32-)=6.82×10-6
③已知:
则反应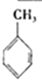 (g)+3H2(g)→
(g)+3H2(g)→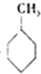 (g)△H=-384KJ•mol-1
(g)△H=-384KJ•mol-1
④常温下,在0.10mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,则NH3•H2O电离被抑制,溶液pH减少.
①在100℃,101KPa条件下,液态水气化热为40.69KJ•mol-1.则H2O(g)=H2O(l) H=+40.69KJ•mol-1
②已知25℃时,MgCO3的Ksp=6.82×10-6,则在该温度下,含有固体MgCO3的溶液中,无论c(Mg2+)与c(CO32-)是否相等,总有c(Mg2+)•c(CO32-)=6.82×10-6
③已知:
| 共价键 | C--C | C=C | C--H | H一H |
| 键能(KJ•mol-1) | 348 | 610 | 413 | 436 |
 (g)+3H2(g)→
(g)+3H2(g)→ (g)△H=-384KJ•mol-1
(g)△H=-384KJ•mol-1④常温下,在0.10mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,则NH3•H2O电离被抑制,溶液pH减少.
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
1.对下列有机反应类型的认识中,错误的是( )
| A. | 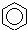 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$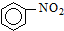 +H2O;取代反应 +H2O;取代反应 | |
| B. | CH4+Cl2→CH3Cl+HCl;置换反应 | |
| C. | CH2=CH2+HCl→CH3-CH2Cl;加成反应 | |
| D. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$2CH3CHO+2H2O;氧化反应 |