题目内容
10.鉴定1,3-二氯丙烷中氯元素的存在,下列描述正确的是( )| A. | 加入NaOH的溶液,加热,冷却后加入AgNO3溶液 | |
| B. | 加入NaOH溶液,加热,冷却后加入足量稀硝酸酸化,再加入AgNO3溶液 | |
| C. | 在氯乙烷中直接加入AgNO3溶液 | |
| D. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 |
分析 卤代烃中卤原子在碱性条件下水解产生卤离子,加硝酸酸化后,再加硝酸银,依据产生沉淀的颜色可以判断卤离子是否存在以及存在何种粒子.
解答 解:鉴定卤代烃中卤元素的存在的操作是:加入NaOH溶液,加热,1,3-二氯丙烷在氢氧化钠水溶液中水解,冷却后,此时溶液为碱性,干扰氯离子的检验,加入足量的硝酸酸化使其呈酸性排除氢氧根的干扰,然后再加入硝酸银溶液来检验卤素离子,若溶液出现白色沉淀,则证明含有氯离子,故B正确,
故选B.
点评 本题考查了卤代烃中卤原子的检验,明确卤代烃水解是在碱性条件下是解题的关键,氢氧根的存在对卤离子的检验造成干扰.

练习册系列答案
相关题目
20.常温下,浓度均为0.1mol•L-1的6种溶液的pH如表:
请根据上述信息回答下列问题:
(1)上述c和d溶液所含溶质对应的酸其酸性强弱为HClO>HCN(用化学式表示);
(2)结合表中数据分析,常温下与溶质a对水的电离程度影响相同的是B;
A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.2mol•L-1的NaCN溶液
(3)用离子方程式表示c溶液呈碱性的原因是ClO-+H2O?HClO+OH-.
(4)如果将b溶液加入到含相同物质的量的BaCl2和ZnCl2的混合稀溶液中,首先析出的沉淀是ZnCO3[已知K(BaCO3)=5.1×10-9,K(ZnCO3)=1.4×10-11].
(5)浓度为0.1mol•L-1的e中离子浓度由大到小的顺序为c(Na+)>c(C6H5O?)>c(OH-)>c(H+).
(6)100℃时纯水中c(H+)=10-6mol•L-1,在此温度下某浓度的d溶液的pH=n,则c(H+)+c(HCN)=10n-12mol•L-1 .
| 溶液 | a | b | c | d | e |
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述c和d溶液所含溶质对应的酸其酸性强弱为HClO>HCN(用化学式表示);
(2)结合表中数据分析,常温下与溶质a对水的电离程度影响相同的是B;
A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.2mol•L-1的NaCN溶液
(3)用离子方程式表示c溶液呈碱性的原因是ClO-+H2O?HClO+OH-.
(4)如果将b溶液加入到含相同物质的量的BaCl2和ZnCl2的混合稀溶液中,首先析出的沉淀是ZnCO3[已知K(BaCO3)=5.1×10-9,K(ZnCO3)=1.4×10-11].
(5)浓度为0.1mol•L-1的e中离子浓度由大到小的顺序为c(Na+)>c(C6H5O?)>c(OH-)>c(H+).
(6)100℃时纯水中c(H+)=10-6mol•L-1,在此温度下某浓度的d溶液的pH=n,则c(H+)+c(HCN)=10n-12mol•L-1 .
1.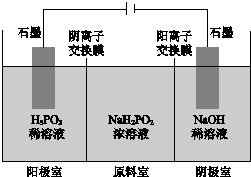 次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解
次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解
NaH2PO2制H3PO2.(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)下列说法正确的是( )
 次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解
次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解NaH2PO2制H3PO2.(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)下列说法正确的是( )
| A. | 阳极室有H2生成 | B. | 阴极室溶液pH减小 | ||
| C. | 原料室溶液pH保持不变 | D. | 阳极室可能有H3PO4生成 |
18.有机物A仅含有C、H、O三种元素,可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
| 实验步骤 | 实验结论 |
(1)A的质谱图如图: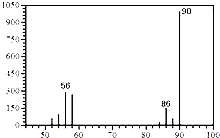 | (1)证明A的相对分子质量为:90. |
| (2)将此9.0g A在足量纯O 2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g. | (2)证明A的分子式为: C3H6O3. |
| (3)另取两份9.0g A分置于不同的试管中. 往其中一份A中加入足量的NaHCO3粉末充分反应,生成2.24 L CO 2 (标准状况). 往另一份A中加入足量的金属钠充分反应,生成2.24 L H 2(标准状况). | (3)证明A的分子中含有一个羧基和一个羟基. |
(4)A的核磁共振氢谱如图: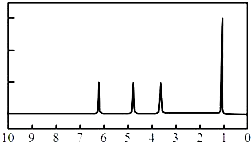 | (4)A的结构简式为:  . . |
15.下列事实一定能说明HNO2为弱电解质的是( )
①常温时NaNO2溶液的pH大于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2与NaCl不能反应
④常温下0.1mol•L-1的HNO2溶液pH=2
⑤1L pH=1的HNO2溶液加水稀释至100L后溶液的pH=2.2
⑥1L pH=1的HNO2溶液和1L pH=1的盐酸分别与足量的NaOH溶液完全反应,最终HNO2消耗的NaOH多.
①常温时NaNO2溶液的pH大于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2与NaCl不能反应
④常温下0.1mol•L-1的HNO2溶液pH=2
⑤1L pH=1的HNO2溶液加水稀释至100L后溶液的pH=2.2
⑥1L pH=1的HNO2溶液和1L pH=1的盐酸分别与足量的NaOH溶液完全反应,最终HNO2消耗的NaOH多.
| A. | ①②③⑥ | B. | ①③④⑤ | C. | ①④⑤⑥ | D. | ②④⑥ |
2.下列各组中的反应,属于同一反应类型的是( )
| A. | 乙烯水化制乙醇;溴乙烷水解制乙醇 | |
| B. | 甲苯使酸性高锰酸钾溶液褪色;丙炔和氢气反应制取丙烷 | |
| C. | 甲苯硝化制TNT;乙炔与氯化氢反应制氯乙烯 | |
| D. | 乙醇脱水制乙烯;溴乙烷脱溴化氢制乙烯 |
19.下列各组有机物,不论以何种比值混合,只要二者物质的量之和不变,完全燃烧时所消耗的氧气的物质的量和生成的水的物质的量分别相等的是( )
| A. | 甲烷和乙醇 | B. | 乙烷和乙醇 | C. | 苯和苯甲酸 | D. | 乙炔和苯 |
20.下列有关叙述不正确的是( )
①在100℃,101KPa条件下,液态水气化热为40.69KJ•mol-1.则H2O(g)=H2O(l) H=+40.69KJ•mol-1
②已知25℃时,MgCO3的Ksp=6.82×10-6,则在该温度下,含有固体MgCO3的溶液中,无论c(Mg2+)与c(CO32-)是否相等,总有c(Mg2+)•c(CO32-)=6.82×10-6
③已知:
则反应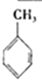 (g)+3H2(g)→
(g)+3H2(g)→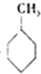 (g)△H=-384KJ•mol-1
(g)△H=-384KJ•mol-1
④常温下,在0.10mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,则NH3•H2O电离被抑制,溶液pH减少.
①在100℃,101KPa条件下,液态水气化热为40.69KJ•mol-1.则H2O(g)=H2O(l) H=+40.69KJ•mol-1
②已知25℃时,MgCO3的Ksp=6.82×10-6,则在该温度下,含有固体MgCO3的溶液中,无论c(Mg2+)与c(CO32-)是否相等,总有c(Mg2+)•c(CO32-)=6.82×10-6
③已知:
| 共价键 | C--C | C=C | C--H | H一H |
| 键能(KJ•mol-1) | 348 | 610 | 413 | 436 |
 (g)+3H2(g)→
(g)+3H2(g)→ (g)△H=-384KJ•mol-1
(g)△H=-384KJ•mol-1④常温下,在0.10mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,则NH3•H2O电离被抑制,溶液pH减少.
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |