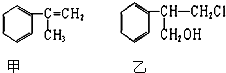
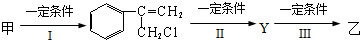题目内容
9.把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平).下列对该反应的说法不正确的是( )
| A. | IO4作氧化剂 | |
| B. | 若有1molMn2+参加反应转移5mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 配平后Mn2+、H+的化学计量数分别为2、3 |
分析 已知锰离子是反应物,反应后生成高锰酸根离子,则锰离子失电子作还原剂,含有碘元素的离子在反应中作氧化剂,碘元素应该得电子化合价降低,所以IO4-是反应物,IO3-是生成物,根据元素守恒知,水是反应物,该反应方程式为:2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+,再根据各物理量之间的关系式判断,以此解答该题.
解答 解:该反应方程式为2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+,
A.IO4-在反应中得电子,I元素化合价降低,作氧化剂,故A正确;
B.若有1mol Mn2+参加反应时则转移=1mol×(7-2)=5 mol电子,故B正确;
C.由方程式可知氧化剂和还原剂的物质的量之比为5:2,故C正确;
D.配平后Mn、H+的化学计量数分别为2、6,故D错误;
故选D.
点评 本题考查氧化还原反应及计算,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意从化合价的角度解答该题,难度不大.

练习册系列答案
相关题目
5.下列有关实验的现象与对应结论均正确的是 ( )
| 选项 | 实验 | 现象 | 结论 |
| A | 铜片加入浓硝酸中 | 产生红棕色气体 | 浓硝酸具有强氧化性 |
| B | 将一小块钠放入乙醇中 | 产生大量气泡 | 该乙醇中含有较多水 |
| C | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 向AgCl悬浊液中滴加KI溶液 | 白色沉淀变黄色 | AgI的溶解度大于AgCl |
| A. | A | B. | B | C. | C | D. | D |
20.常温下,浓度均为0.1mol•L-1的6种溶液的pH如表:
请根据上述信息回答下列问题:
(1)上述c和d溶液所含溶质对应的酸其酸性强弱为HClO>HCN(用化学式表示);
(2)结合表中数据分析,常温下与溶质a对水的电离程度影响相同的是B;
A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.2mol•L-1的NaCN溶液
(3)用离子方程式表示c溶液呈碱性的原因是ClO-+H2O?HClO+OH-.
(4)如果将b溶液加入到含相同物质的量的BaCl2和ZnCl2的混合稀溶液中,首先析出的沉淀是ZnCO3[已知K(BaCO3)=5.1×10-9,K(ZnCO3)=1.4×10-11].
(5)浓度为0.1mol•L-1的e中离子浓度由大到小的顺序为c(Na+)>c(C6H5O?)>c(OH-)>c(H+).
(6)100℃时纯水中c(H+)=10-6mol•L-1,在此温度下某浓度的d溶液的pH=n,则c(H+)+c(HCN)=10n-12mol•L-1 .
| 溶液 | a | b | c | d | e |
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述c和d溶液所含溶质对应的酸其酸性强弱为HClO>HCN(用化学式表示);
(2)结合表中数据分析,常温下与溶质a对水的电离程度影响相同的是B;
A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.2mol•L-1的NaCN溶液
(3)用离子方程式表示c溶液呈碱性的原因是ClO-+H2O?HClO+OH-.
(4)如果将b溶液加入到含相同物质的量的BaCl2和ZnCl2的混合稀溶液中,首先析出的沉淀是ZnCO3[已知K(BaCO3)=5.1×10-9,K(ZnCO3)=1.4×10-11].
(5)浓度为0.1mol•L-1的e中离子浓度由大到小的顺序为c(Na+)>c(C6H5O?)>c(OH-)>c(H+).
(6)100℃时纯水中c(H+)=10-6mol•L-1,在此温度下某浓度的d溶液的pH=n,则c(H+)+c(HCN)=10n-12mol•L-1 .
17.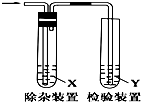 用图所示装置检验乙烯时不需要除杂的是( )
用图所示装置检验乙烯时不需要除杂的是( )
 用图所示装置检验乙烯时不需要除杂的是( )
用图所示装置检验乙烯时不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 溴水 |
| A. | A | B. | B | C. | C | D. | D |
14.下列实验操作能达到实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 向FeCl3溶液中滴加NaOH溶液 | 制备Fe(OH)3胶体 |
| B | 将CO2通入水玻璃溶液中 | 证明C元素的非金属性大于Si |
| C | 向苯和苯酚的混合溶液中加入足量的浓溴水,充分反应后过滤 | 除去苯中混有的苯酚 |
| D | 淀粉与稀H2SO4共热,再加入银氨溶液水浴加热 | 验证淀粉水解产物有无还原性 |
| A. | A | B. | B | C. | C | D. | D |
1.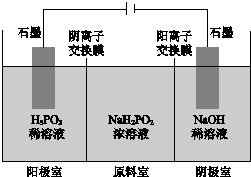 次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解
次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解
NaH2PO2制H3PO2.(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)下列说法正确的是( )
 次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解
次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解NaH2PO2制H3PO2.(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)下列说法正确的是( )
| A. | 阳极室有H2生成 | B. | 阴极室溶液pH减小 | ||
| C. | 原料室溶液pH保持不变 | D. | 阳极室可能有H3PO4生成 |
18.有机物A仅含有C、H、O三种元素,可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
| 实验步骤 | 实验结论 |
(1)A的质谱图如图: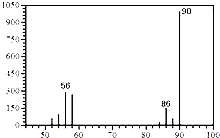 | (1)证明A的相对分子质量为:90. |
| (2)将此9.0g A在足量纯O 2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g. | (2)证明A的分子式为: C3H6O3. |
| (3)另取两份9.0g A分置于不同的试管中. 往其中一份A中加入足量的NaHCO3粉末充分反应,生成2.24 L CO 2 (标准状况). 往另一份A中加入足量的金属钠充分反应,生成2.24 L H 2(标准状况). | (3)证明A的分子中含有一个羧基和一个羟基. |
(4)A的核磁共振氢谱如图: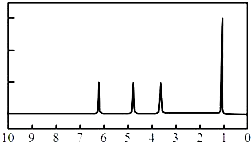 | (4)A的结构简式为:  . . |
19.下列各组有机物,不论以何种比值混合,只要二者物质的量之和不变,完全燃烧时所消耗的氧气的物质的量和生成的水的物质的量分别相等的是( )
| A. | 甲烷和乙醇 | B. | 乙烷和乙醇 | C. | 苯和苯甲酸 | D. | 乙炔和苯 |