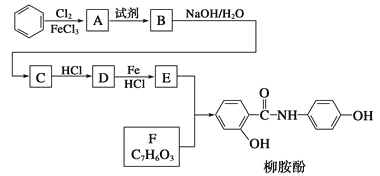
题目内容
【题目】利用“化学计量在实验中的应用”相关知识填空.
(1)147g H2SO4的物质的量是 , 其中含氢原子数为个.
(2)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为 , 含R的质量为1.6g的Na2R,其物质的量为 .
(3)在标准状况下,CO和CO2的混合气体共39.2L,质量为61g.则两种气体的物质的量之和mol.其中CO占总体积的%.
(4)448mL某气体在标准状况下的质量为1.28g,则该气体的相对分子质量为 .
(5)某混合物由NaCl、MgCl、AlCl3组成,已知Na、Mg、Al三元素的质量之比为23:16:9,则NaCl、MgCl2和AlCl3物质的量之比为 , 含1.00mol Cl﹣的该混合物的质量为
【答案】
(1)1.5 mol;1.806×1024
(2)62g/mol;0.1mol
(3)1.75;57.1
(4)64
(5)3:2:1;49.9 g
【解析】解:(1)147g H2SO4的物质的量是 ![]() =1.5mol,其中含有氢原子物质的量为1.5mol×2=3mol,含有氢原子数为3mol×4×6.02×1023mol﹣1=1.806×1024
=1.5mol,其中含有氢原子物质的量为1.5mol×2=3mol,含有氢原子数为3mol×4×6.02×1023mol﹣1=1.806×1024
, 所以答案是:1.5 mol;1.806×1024; (2)根据化学式可知Na2R中n(Na+)=2n(Na2R),所以含有0.4molNa+的Na2R的物质的量为 ![]() =0.2mol,所以Na2R的摩尔质量为
=0.2mol,所以Na2R的摩尔质量为 ![]() =62g/mol;
=62g/mol;
当摩尔质量以g/mol作单位,数值上等于其相对分子质量,即Na2R的相对分子质量为62,所以R的相对原子质量为62﹣23×2=16;
1.6gR的物质的量为 ![]() =0.1mol,根据化学式可知Na2R中n(Na2R)=n(R)=0.1mol.
=0.1mol,根据化学式可知Na2R中n(Na2R)=n(R)=0.1mol.
所以答案是:62g/mol;0.1mol;(3)两种气体的物质的量之和为 ![]() =1.75mol,
=1.75mol,
设混合气体中CO的物质的量为x,CO2的物质的量为y,
则有 ![]() ,
,
解得x=1mol,y=0.75mol,
CO占总体积的体积分数即为物质的量分数,为 ![]() ×100%≈57.1%,
×100%≈57.1%,
所以答案是:1.75;57.1;(4)在标准状况下的448ml某气体的物质的量为 ![]() =0.02mol,其摩尔质量M=
=0.02mol,其摩尔质量M= ![]() =64g/mol,
=64g/mol,
以g/mol为单位时,相对分子质量数值上等于其摩尔质量,所以该气体的相对分子质量为64,所以答案是:64;(5)假设Na、Mg、Al三元素的质量分别为23g、16g、9g,
n(NaCl)=n(Na)= ![]() =1mol,
=1mol,
n(MgCl2)=n(Mg)= ![]() =
= ![]() mol,
mol,
n(AlCl3)=n(Al)= ![]() =
= ![]() mol,
mol,
故n(NaCl):n(MgCl2):n(AlCl3)=1mol: ![]() mol:
mol: ![]() mol=3:2:1,
mol=3:2:1,
设AlCl3的物质的量为x,则:
1mol=3x+2x×2+3x
解得x=0.1
故混合物的总质量为0.1mol×3×58.5g.mol+0.1mol×2×95g/mol+0.1mol×133.5g/mol=49.9g,
所以答案是:3:2:1;49.9.

【题目】课外实验小组为了探究锌与盐酸反应过程中的化学反应速率的变化,在100mL稀盐酸中加入足量的锌粉,标准状况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min,下同)反应速率最大,可能的原因 .
(2)哪一段时段的反应速率最小 , 原因是 .
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率为 .
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.蒸馏水
B.CH3COONa固体
C.Na2CO3溶液
D.CuSO4溶液你认为可行的是(填编号).