��Ŀ����
����Ŀ����֪��
2H2(g����O2(g��===2H2O(l�� ��H����571.6 kJ��mol��1
2CH3OH(l����3O2(g��===2CO2(g����4H2O(l����H����1452 kJ��mol��1
H��(aq����OH��(aq��===H2O(l�� ��H����57.3 kJ��mol��1
����˵����ȷ���� �� ��
A. H2(g����ȼ����Ϊ571.6 kJ��mol��1
B. ͬ������H2(g����CH3OH(l����ȫȼ�գ�H2(g���ų���������
C. ![]() H2SO4(aq����
H2SO4(aq����![]() Ba(OH��2(aq��===
Ba(OH��2(aq��===![]() BaSO4(s����H2O(l�� ��H����57.3 kJ��mol��1
BaSO4(s����H2O(l�� ��H����57.3 kJ��mol��1
D. 3H2(g����CO2(g��=CH3OH(l����H2O(l�� ��H����135.9 kJ��mol��1
���𰸡�B
�����������������A.ȼ������1mol������ȫȼ�ղ����ȶ���������ʱ���ų�������������ʽ�и�������2mol��������ȫȼ�����ų�������Ϊ571.6 kJ��A����B.�ɷ���ʽ��֪1gH2ȼ�շų�����142.9kJ��1gCH3OH��l����ȫȼ�շų�����1452 kJ��32=45.375kJ����ͬ������H2��g����CH3OH��l����ȫȼ�գ�H2��g���ų��������࣬B��ȷ��C.�ڷ�Ӧ1/2H2SO4��aq����1/2Ba��OH��2��aq����1/2BaSO4��s����H2O��l���г���H+��OH-��Ӧ����ˮ�⣬���г����������ų�������57.3 kJ�࣬C����D.���ݸ�˹���ɣ������١�3��������2 �����ɵ�3H2��g����CO2��g���� CH3OH��l����H2O��l�� ��H����131.4kJ��mol��1��D����ѡB��

����Ŀ������������
��1�����£��ݻ�Ϊ1L���������£�����Է�������ת�����䷴Ӧ���̺�������ϵ��ͼ��ʾ����֪��2SO2��g��+O2��g��2SO3��g����H=��196.6kJmol��1������ش��������⣺ 
��д���ܱ�ʾ���ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
������ͬ�����£�����1mol SO3��0.5mol ��O2 �� ��ﵽƽ��ʱSO3��ת����Ϊ����ʱ�÷�Ӧ����ų��������ա���KJ��������
��2����CO2��ת�����л���ʵ��̼ѭ���������Ϊ1L���ܱ������У�����1molCO2��3molH2 �� һ�������·�Ӧ��CO2��g��+3H2��g��CH3OH��g��+H2O��g����H=��49.0kJmol��1 �� ���CO2��CH3OH��g��Ũ����ʱ��仯��ͼ��ʾ����3min��9min��v��H2��=molL��1min��1 �� 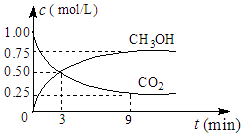
����˵��������Ӧ�ﵽƽ��״̬���������ţ���
A����Ӧ��CO2��CH3OH�����ʵ���Ũ��֮��Ϊ1��1����ͼ�н���㣩
B�����������ܶȲ���ʱ��ı仯���仯
C����λʱ��������3mol H2 �� ͬʱ����1mol H2O
D��CO2����������ڻ�������б��ֲ���
��3����ҵ�ϣ�CH3OHҲ����CO��H2�ϳɣ��ο��ϳɷ�ӦCO��g��+2H2��g��CH3OH��g����ƽ�ⳣ��������˵����ȷ����
�¶�/�� | 0 | 100 | 200 | 300 | 400 |
ƽ�ⳣ�� | 667 | 13 | 1.9��10��2 | 2.4��10��4 | 1��10��5 |
A.�÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ
B.�÷�Ӧ�ڵ����²����Է����У������¿��Է����У�˵���÷�Ӧ��S��0
C.��T��ʱ��1L�ܱ������У�Ͷ��0.1mol CO��0.2mol H2 �� �ﵽƽ��ʱ��COת����Ϊ50%�����ʱ��ƽ�ⳣ��Ϊ100
D.��ҵ�ϲ����Ըߵ�ѹǿ��5MPa����250�棬����Ϊ�������£�ԭ����ת������ߣ�