题目内容
【题目】实验室常用浓盐酸与高锰酸钾发生反应快速制备少量氯气。化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(1)用单线桥法表示该反应过程中的电子转移情况。______
(2)该反应中Cl2是___(填氧化剂、还原剂、氧化产物或还原产物),HCl被氧化部分和未被氧化部分之比为___。

已知:氯气有毒,溶入水显酸性(反应方程式为Cl2+H2O=HCl +HClO)。氯气在饱和食盐水中的溶解度很小,氯化氢在饱和食盐水中的溶解度则很大。
(3)装置C的作用是___,装置D的作用是____,为了避免尾气排入空气污染环境,装置F中的试剂是___。
(4)氯气与水反应过程中,氧化剂和还原剂之比为___。
【答案】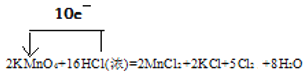 氧化产物 5:3 除HCl 干燥氯气 NaOH溶液/KOH溶液 1:1
氧化产物 5:3 除HCl 干燥氯气 NaOH溶液/KOH溶液 1:1
【解析】
(1)在反应中,Mn的化合价由+7价降低到+2价,得到电子,2molKMnO4得到10mol电子。盐酸中的氯的化合价升高,由-1价升高到0价,16molHCl中只有10mol发生了氧化反应,另外的6mol没有发生化合价的变化,10molHCl失去10mol电子。故用单线桥法表示该反应过程中的电子转移情况为: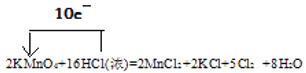 。
。
(2)该反应中Cl2是由HCl中的-1价的氯化合价升高得到的,所以是氧化产物,16molHCl中被氧化的为10mol,未被氧化部分的为6mol,故被氧化部分和未被氧化部分之比为5:3。故答案为:氧化产物,5:3。
(3)由于浓盐酸挥发,所以氯气中会混有HCl和水蒸气,氯气在饱和食盐水中的溶解度很小,氯化氢在饱和食盐水中的溶解度则很大,所以可以用饱和食盐水除去氯气中的HCl,用浓硫酸除去氯气中的水蒸气。应先除HCl,再除水蒸气,如果先除去水蒸气,再通过饱和食盐水除去HCl的同时又会带出水蒸气,所以装置C的作用是除HCl,装置D的作用是干燥氯气,为了避免尾气排入空气污染环境,可以用NaOH溶液或KOH溶液吸收多余的氯气,故装置F中的试剂是NaOH溶液/KOH溶液。故答案为:除HCl,干燥氯气,NaOH溶液或KOH溶液。
(4)氯气与水反应为:Cl2+H2O![]() HCl+HClO,Cl2中的氯元素的化合价既升高又降低,所以Cl2既是氧化剂又是还原剂,而且1moLCl2中的2molCl,其中1molCl的化合价升高到+1价,另1molCl的化合价降低到-1价,所以氧化剂和还原剂之比为1:1。
HCl+HClO,Cl2中的氯元素的化合价既升高又降低,所以Cl2既是氧化剂又是还原剂,而且1moLCl2中的2molCl,其中1molCl的化合价升高到+1价,另1molCl的化合价降低到-1价,所以氧化剂和还原剂之比为1:1。







