题目内容
7. 资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.
资料表明,硫粉与热的KOH溶液共热生成两种盐,其中一种是K2SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.(1)兴趣小组同学认为,上述反应的生成物可能与反应温度(T),KOH溶液的浓度(C)有关.他们做了如下对比实验(每次反应中硫粉的质量、KOH溶液的体积均相同).
| 实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| T/℃ | 50 | 60 | 70 | 80 | 90 | |||
| c/mol•L-1 | 1.0 | 3.0 | 4.0 | 5.0 | 6.0 |
(2)兴趣小组设计实验对上述反应中生成的盐的成分进行探究.他们提出如下假设,请你根据氧化还原反应的规律,完成假设二和假设三:
假设一:生成的盐是K2S和K2SO3;
假设二:生成的盐是K2S和K2SO4;
假设三:生成的盐是K2S,K2SO3和K2SO4;
(3)请你设计实验验证上述假设一.完成下表中内容.(除了硫粉与热的KOH溶液的反应液之外,可供选择的药品有稀硝酸,稀盐酸等;已知:6H++SO32-+2S2-=3S+3H2O)
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在反应液中加入足量的稀盐酸 | 若溶液变浑浊且没有气体溢出(或:若没有气体溢出),则假设一成立;若溶液中有气体逸出,则假设一不成立 |
(5)请分析上述反应中有K2SO4生成的可能原因是:亚硫酸钾具有还原性,很容易被氧气氧化为硫酸钾.
分析 (1)探究条件对反应速率和生成物的影响,保持其他条件不变,改变其中一个条件分析判断对生成物的影响;
(2)硫粉与热的KOH溶液共热生成两种盐,其中一种是K2SO3.某化学兴趣小组进行该实验时,却检测到生成的盐中含有SO42-.说明可能产物为K2S,K2SO3或K2S,K2SO4 或K2S,K2SO3和K2SO4;
(3)若生成的盐是K2S和K2SO3,依据氧化还原反应的规律,如果假设2和3成立,那么反应过程中会有H2S气体生成;
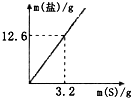
(4)3.2g硫粉即0.1mol硫与热的KOH溶液共热,不管是生成那种情况的产物,质量都是12.6g,据此回答;
(5)根据亚硫酸钾具有还原性,很容易被氧气氧化为硫酸钾来回答.
解答 解:(1)实验①~④是探究温度对生成物的影响,浓度不变,⑤~⑧是探究KOH溶液的浓度对生成物的影响,温度不变,
故答案为:
| 实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| T/℃ | 90 | 90 | 90 | |||||
| c/mol•L-1 | 1.0 | 1.0 | 1.0 |
故答案为:K2S和K2SO4,K2S,K2SO3和K2SO4;
(3)硫离子、亚硫酸根离子、氢离子之间会发生反应生成硫单质,检测生成的盐是K2S和K2S03的混合物,可以向反应液中加入足量的盐酸,看是否出现淡黄色浑浊物质,如果出现淡黄色浑浊,证明假设一成立,
故答案为:
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在反应液中加入足量的稀盐酸 | 若溶液变浑浊且没有气体溢出(或:若没有气体溢出),则假设一成立;若溶液中有气体逸出,则假设一不成立 |
(5)亚硫酸钾具有还原性,很容易被氧气氧化为硫酸钾,所以上述反应中会有硫酸钾,
故答案为:亚硫酸钾具有还原性,很容易被氧气氧化为硫酸钾.
点评 本题是一道物质的检测和实验方案设计题,考查学生分析和解决问题的能力,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列有关化学用语使用正确的是( )
| A. | H2O的电子式: | B. | 硫原子的原子结构示意图: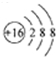 | ||
| C. | CO2的比例模型: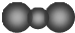 | D. | 基态氧原子的轨道表示式为: |
15.20℃时对0.2mol•L-1的HA溶液中,改变下列条件一定能使HA的电离平衡正向移动的是( )
| A. | 保持温度不变,再加0.2mol•L-1的HA溶液 | |
| B. | 保持浓度不变,升高温度 | |
| C. | 保持温度不变,加水 | |
| D. | 增大压强 |
2.下列反应中溶液中的H+浓度显著增大的是( )
| A. | 将SO2通入品红溶液中 | B. | 将Cl2通入KI溶液中 | ||
| C. | 将SO2通入溴水中 | D. | 将H2S通入硝酸溶液中 |
12.Na2O与Na2O2的相同点是( )
| A. | 氧元素化合价 | B. | 颜色状态 | C. | 阴、阳离子个数比 | D. | 为碱性氧化物 |
 .
.
 ;
;