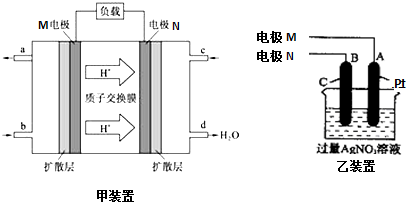
题目内容
3.下列图示实验合理的是( )
| A. | 图1为证明S、C、Si元素的非金属性强弱的装置 | |
| B. | 图2为可随开随停制备少量氧气的装置 | |
| C. | 图3为配制100mL一定浓度硫酸溶液 | |
| D. | 图4制备并收集少量NO2气体 |
分析 A.发生强酸制取弱酸的反应,且非金属性越强,最高价含氧酸的酸性越强;
B.过氧化钠为粉末固体,与水接触后不能分离;
C.不能在容量瓶中稀释浓硫酸;
D.二氧化氮与水反应.
解答 解:A.发生强酸制取弱酸的反应,酸性为硫酸>碳酸>硅酸,则非金属性S>C>Si,故A正确;
B.过氧化钠为粉末固体,与水接触后不能分离,则不能随开随停制备少量氧气,故B错误;
C.不能在容量瓶中稀释浓硫酸,应在烧杯中稀释、冷却后转移到容量瓶中,故C错误;
D.二氧化氮与水反应,不能利用图中排水法收集,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及酸性比较、气体的制备及收集、溶液配制等,把握物质的性质及反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析及实验装置的作用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列叙述中,错误的是( )
| A. | 纯水在25℃和80℃时的氢离子浓度,前者小于后者 | |
| B. | 常温下,0.01mol/L的NaOH溶液中,由水电离出的c(H+)为10-2mol/L | |
| C. | pH=6的溶液不一定呈酸性,c(H+)>c(OH-)的溶液才是酸性溶液 | |
| D. | 温度升高,水的离子积常数会增大 |
8.下列叙述中正确的是( )
| A. | 最外层为2个电子的原子都是金属原子 | |
| B. | 电子能量越低,其运动区域离核越近 | |
| C. | 每个电子层作为最外层时,最多可容纳的电子数均为8 | |
| D. | 从Li到F、从Na到Cl,元素的最高正化合价均呈现从+1到+7价的变化 |
15.过量铁粉与100mL 0.01mol•L-1的稀盐酸反应.为了加快此反应速率而不改变H2的总量,可以使用如下方法中的( )
| A. | 加NaCl溶液 | B. | 加水 | ||
| C. | 升高温度(不考虑盐酸挥发) | D. | 滴入几滴浓盐酸 |
12.在下列各组离子中,能大量共存的是( )
| A. | Al3+、H+、AlO2-、Cl- | B. | Cu2+、Fe2+、ClO-、SO42- | ||
| C. | Na+、Ca2+、HCO3-、Cl- | D. | Cu2+、Fe3+、Cl-、NO3- |

 .
. .
. .
.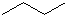
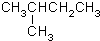
 CH3CH=CHCH3
CH3CH=CHCH3
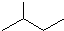
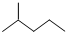 分子式C6H14用系统命名法对该有机物进行命名2-甲基戊烷
分子式C6H14用系统命名法对该有机物进行命名2-甲基戊烷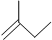 分子式C5H10③
分子式C5H10③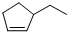 分子式C7H12
分子式C7H12