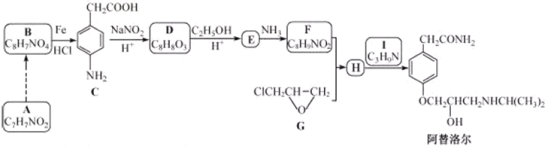
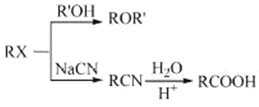
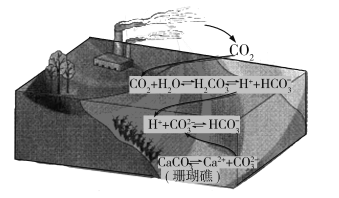
题目内容
【题目】以酚酞为指示剂,用0.1000 mol·L1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数![]() 随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2的分布系数:
随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2的分布系数:![]() ]
]

下列叙述正确的是
A. 曲线①代表![]() ,曲线②代表
,曲线②代表![]()
B. H2A溶液的浓度为0.2000 mol·L1
C. HA的电离常数Ka=1.0×102
D. 滴定终点时,溶液中![]()
【答案】C
【解析】
根据图像,曲线①代表的粒子的分布系数随着NaOH的滴入逐渐减小,曲线②代表的粒子的分布系数随着NaOH的滴入逐渐增大,粒子的分布系数只有1个交点;当加入40mLNaOH溶液时,溶液的pH在中性发生突变,且曲线②代表的粒子达到最大值接近1;没有加入NaOH时,pH约为1,说明H2A第一步完全电离,第二步部分电离,曲线①代表δ(HA-),曲线②代表δ(A2-),根据反应2NaOH+H2A=Na2A+2H2O,c(H2A)=![]() =0.1000mol/L,据此分析作答。
=0.1000mol/L,据此分析作答。
A.根据分析,曲线①代表δ(HA-),曲线②代表δ(A2-),A错误;
B.当加入40.00mLNaOH溶液时,溶液的pH发生突变,说明恰好完全反应,结合分析,根据反应2NaOH+H2A=Na2A+2H2O,c(H2A)= ![]() =0.1000mol/L,B错误;
=0.1000mol/L,B错误;
C.根据曲线当δ(HA-)=δ(A2-)时溶液的pH=2,则HA-的电离平衡常数Ka=![]() =c(H+)=1×10-2,C正确;
=c(H+)=1×10-2,C正确;
D.用酚酞作指示剂,酚酞变色的pH范围为8.2~10,终点时溶液呈碱性,c(OH-)>c(H+),溶液中的电荷守恒为c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),则c(Na+)>2c(A2-)+c(HA-),D错误;
答案选C。