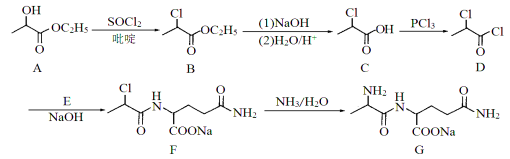
题目内容
【题目】如图所示,下列说法正确的是( )
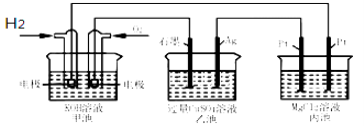
A.甲池通入O2的电极反应为O2 + 4e-+ 4H+=2H2O
B.乙池 Ag电极增重6.4g,溶液中将转移0.2mol电子
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
【答案】D
【解析】
试题分析:A.甲池是燃料电池,通入O2的电极为正极,电极反应为O2 + 4e-+ 2H2O=4OH-,故A错误;B.乙池是电解池,Ag电极为阳极,电解过程中Ag要发生氧化反应,质量减轻,故B错误;C.电解池乙池中,电解后生成硫酸、铜和氧气,要想复原,要加入氧化铜,故C错误;D.甲池中根据电极反应:O2+2H2O+4e-=4OH-,所以消耗280mL(标准状况下0.0125mol)O2,则转移电子0.05mol,根据丙装置中,在阴极上是氢离子放电,转移电子0.05mol,减小的氢离子是0.05mol,氢氧根离子是0.05mol,镁离子和氢氧根离子之间反应生成氢氧化镁,理论上最多产生氢氧化镁质量应该是0.05mol×1/2×58g/mol=1.45g固体,故D正确;故选D。

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目