题目内容
1.分别向下列物质的水溶液中加入少量过氧化钠固体,不会出现浑浊现象的是( )| A. | 饱和石灰水 | B. | 氢硫酸 | C. | 碳酸氢钙溶液 | D. | 碳酸氢钠溶液 |
分析 过氧化钠与水反应生成NaOH溶液和氧气,氢氧化钠可与碳酸氢钙反应生成碳酸钙沉淀,过氧化钠、氧气具有氧化性,能将还原性的物质氧化,以此解答该题.
解答 解:过氧化钠与水反应生成NaOH溶液,
A.过氧化钠加入饱和氢氧化钙溶液中,和水反应,溶剂质量减小,饱和溶液析出固体,变浑浊,故A不选;
B.加入到氢硫酸溶液中生成硫单质,是一种沉淀,故B不选;
C.加入到碳酸氢钙溶液中生成碳酸钙沉淀,故C不选;
D.加入到碳酸氢钠溶液中生成碳酸钠,碳酸钠溶解度比碳酸氢钠大,没有沉淀析出,故D选.
故选D.
点评 本题考查过氧化钠的性质,题目难度不大,注意相关基础知识的积累,答题时要注意审题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.在H、O、C、Na四种元素中,选择适当的元素组成符合如表要求的物质,将它们的化学式填写在空格中.
| 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 正盐 | 酸式盐 |
| CO2 | Na2O | H2CO3 | NaOH | Na2CO3 | NaHCO3 |
12.利用下述操作步骤:①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加盐酸生成Al(OH)3沉淀,由含少量铁粉的铝粉制取纯净的氢氧化铝,最恰当的组合是( )
| A. | ②③④③ | B. | ②③⑤③ | C. | ①③④③ | D. | ②⑤③④ |
16.下列说法中正确的是( )
| A. | 10 L 0.05mol•L-1Ba(OH)2溶液与10 L 0.05mol•L-1 H2SO4反应时的反应热是中和热 | |
| B. | 由2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1知,该反应的反应热为571.6 kJ•mol-1 | |
| C. | 由2H2(l)+O2(l)=2H2O(g)△H=-482.6 kJ•mol-1知,H2的燃烧热为482.6 kJ•mol-1 | |
| D. | 由C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5 kJ•mol-1知,气体C3H8的燃烧热为2221.5 kJ•mol-1 |
13.25℃时,在强碱性溶液中可以大量共存的离子组是( )
| A. | K+、Cu2+、SO32-、MnO4- | B. | NH4+、Fe2+、NO3-、H+ | ||
| C. | HCO3-、Na+、Mg2+、Cl- | D. | Na+、K+、SO42-、Cl- |
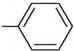 中的两种基团组成的化合物,与NaOH溶液恰好完全发生反应,反应后所得产物中再通入二氧化碳,也能发生反应的物质可能是苯酚钠、碳酸钠.
中的两种基团组成的化合物,与NaOH溶液恰好完全发生反应,反应后所得产物中再通入二氧化碳,也能发生反应的物质可能是苯酚钠、碳酸钠.
 已知在酸性条件下有以下反应:①2BrO3-+I2═2IO3-+Br2;②2IO3-+10Br-+12H+═I2+5Br2+6H2O.
已知在酸性条件下有以下反应:①2BrO3-+I2═2IO3-+Br2;②2IO3-+10Br-+12H+═I2+5Br2+6H2O.