题目内容
4.NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol放出热量9.2kJ时,转移电子0.6NA | |
| C. | 0.1mol/LNH4Cl溶液中Cl-离子数目为0.1NA | |
| D. | 0.1molH2O2分子中含极性共价键数目为0.3NA |
分析 A、求出 CaO2的物质的量,然后根据CaO2由钙离子和过氧根构成来分析;
B、反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol转移6mol电子;
C、溶液体积不明确;
D、H2O2分子中含2个极性共价键.
解答 解:A、7.2gCaO2晶体的物质的量n=$\frac{m}{M}$=$\frac{7.2g}{72g/mol}$=0.1mol,而CaO2晶体中含1个钙离子和1个过氧根离子,故0.1molCaO2中含0.2mol离子,故A错误;
B、反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol转移6mol电子,放出热量9.2 kJ时,转移电子0.6 NA,故B正确;
C、溶液体积不明确,故无法计算氯离子数目,故C错误;
D、H2O2分子中含2个极性共价键,故0.1 mol H2O2分子中含极性共价键数目为0.2 NA,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用、物质的状态和物质的结构是关键,难度不大.

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
14.下列有关说法不正确的是( )
| A. | 物质的量表示含有一定数目粒子的集合体 | |
| B. | 物质的量是联系微观粒子和宏观物质的物理量 | |
| C. | 0.012kg 12C中所含碳原子数约为6.02×1023 | |
| D. | 物质的量可用于表示宏观物质的多少 |
15.下列表示物质或微粒的化学用语或模型正确的是( )
| A. | 氮气分子的结构式:N-N | B. | Mg2+的结构示意图: | ||
| C. | 乙醇的结构简式:CH3CH2OH | D. | 二氧化碳电子: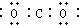 |
12.利用下述操作步骤:①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加盐酸生成Al(OH)3沉淀,由含少量铁粉的铝粉制取纯净的氢氧化铝,最恰当的组合是( )
| A. | ②③④③ | B. | ②③⑤③ | C. | ①③④③ | D. | ②⑤③④ |
19.化学是你,化学是我.下列有关说法错误的是( )
| A. | PVC保鲜膜属于链状聚合物,在加热时易熔化,能溶于氯仿 | |
| B. | 汽车尾气排放的NO2等气体是造成光化学污染的主要原因 | |
| C. | 焰色反应是金素元素的性质,属于化学变化 | |
| D. | 误食含有大量Cu2+的食物可以服用鲜牛奶解毒 |
16.下列说法中正确的是( )
| A. | 10 L 0.05mol•L-1Ba(OH)2溶液与10 L 0.05mol•L-1 H2SO4反应时的反应热是中和热 | |
| B. | 由2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1知,该反应的反应热为571.6 kJ•mol-1 | |
| C. | 由2H2(l)+O2(l)=2H2O(g)△H=-482.6 kJ•mol-1知,H2的燃烧热为482.6 kJ•mol-1 | |
| D. | 由C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5 kJ•mol-1知,气体C3H8的燃烧热为2221.5 kJ•mol-1 |
13.25℃时,在强碱性溶液中可以大量共存的离子组是( )
| A. | K+、Cu2+、SO32-、MnO4- | B. | NH4+、Fe2+、NO3-、H+ | ||
| C. | HCO3-、Na+、Mg2+、Cl- | D. | Na+、K+、SO42-、Cl- |
7.下列反应既属于氧化还原反应,又属于吸热反应的是( )
| A. | 铝片与稀盐酸的反应 | B. | 氢氧化钡晶体与氯化铵晶体的反应 | ||
| C. | 甲烷在氧气中的燃烧反应 | D. | 灼热的碳与二氧化碳的反应 |
