题目内容
1.部分弱酸的电离平衡常数如下表:| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 2CN-+H2O+CO2=2HCN+CO32- | |
| B. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 | |
| C. | 物质的量浓度相等的HCOONa和KCN溶液中,c(HCOOH)+c(HCOO-)=c(CN-)+c(HCN) | |
| D. | c(NH4+)相等的HCOONH4溶液、NH4CN溶液中,c(NH4CN)>c(HCOONH4) |
分析 弱酸的电离平衡常数越大,其酸性越强,等pH的弱酸溶液,酸性越强的酸其物质的量浓度越小,弱酸根离子水解程度越小,结合强酸能和弱酸盐反应制取弱酸分析解答.
解答 解:酸的电离平衡常数HCOOH>H2CO3>HCN>HCO3-,则酸根离子水解程度CO32->CN->HCO3->HCOO-,
A、酸的电离平衡常数越大,酸的酸性越强,强酸能够制取弱酸,所以二者反应生成HCN和HCO3-,离子方程式为CN-+H2O+CO2═HCN+HCO3-,故A错误;
B、等pH、等体积的HCOOH和HCN,n(HCN)>n(HCOOH),中和酸需要碱的物质的量与酸的物质的量、酸的元数成正比,所以中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故B正确;
C、物质的量浓度相等的HCOONa和KCN中c(Na+)=c(K+),据物料守恒有c(HCOOH)+c(HCOO-)=c(CN-)+c(HCN),故C正确;
D、酸的电离平衡常数HCOOH>HCN,则酸根离子水解程度CN->HCOO-,促进铵根离子水解程度大小顺序是CN->HCOO-,则相同浓度的这几种盐溶液中c(NH4+)大小顺序是c(NH4CN)<c(HCOONH4),所以c(NH4+)相等的HCOONH4溶液、NH4CN溶液中c(NH4CN)>c(HCOONH4),故D正确;
故选A.
点评 本题考查了离子浓度大小比较,明确酸的电离平衡常数与酸的强弱、酸根离子水解程度大小之间的关系是解本题关键,再结合物料守恒、物质的性质等知识点来分析解答,易错选项是D,会采用逆向思维的方法确定盐溶液浓度,知道弱酸根离子和弱碱离子相互促进水解,题目难度中等.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
16.下列实验能达到目的是( )
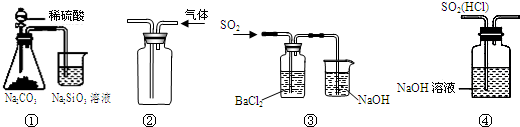

| A. | 图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②装置收集CO2气体 | |
| C. | 用图③装置制备BaSO3沉淀 | |
| D. | 用图④装置除去SO2中的HCl |
6.下列物质不属于高分子化合物的是( )
| A. | 纤维素 | B. | 蛋白质 | C. | 淀粉 | D. | 蔗糖 |
13.下列说法不正确的是( )
| A. | 液化石油气(LPG)的主要成份是碳氢化合物 | |
| B. | 光化学烟雾是氮氧化物和烃的排放引发的环境污染 | |
| C. | CHCl3不存在同分异构体,可以证明甲烷是以碳原子为中心的正四面体结构 | |
| D. | 甲烷与二氧化碳一样,也是一种温室气体 |
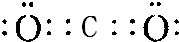 ,Y与W形成的原子个数比为1:1的化合物的电子式是
,Y与W形成的原子个数比为1:1的化合物的电子式是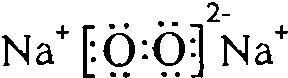 .
.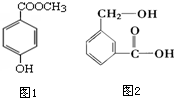 分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质有广泛用途.
分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质有广泛用途.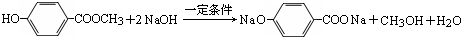 .
.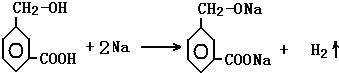 .
.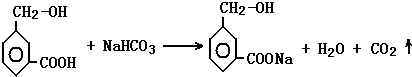 .
.
 .
. .
.