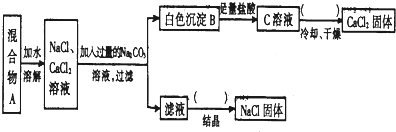
题目内容
20.依据事实,写出下列反应的热化学方程式.(1)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O. 放出571.6kJ的热量,表示H2燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol.
(2)在25℃、101kPa下,1g甲醇液体燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1
(3)已知:已知:C(s)+O2(g)=CO2(g)△H=-437.3kJ•mol一1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8kJ•mol一1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol一1
则煤的气化主要反应(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式是C(s)+H2O(g)=CO2(g)+H2(g)△H=-131.5kJ•mol-1.
分析 (1)燃烧热指1mol可燃物完全燃烧生成稳定的化合物时所放出的热量;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成CO2和液态水时放热22.68kJ×32=725.76kJ,1mol甲醇质量为32克,所以完全燃烧1mol甲醇生成二氧化碳和液态水放热725.76KJ,根据燃烧热的概念分析即可解答;
(3)依据热化学方程式和盖斯定律计算所需热化学方程式,由此解答.
解答 解:(1)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,即2mol氢气完全燃烧放出571.6kJ的热量,则1mol氢气完全燃烧放出的燃量为285.8KJ,所以氢气的燃烧热为-285.8KJ/mol,氢气和氧气都是气态,水是液态,则氢气的燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol;
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol;
(2)1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ,燃烧热热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1;解:①C(s)+O2(g)═CO2(g)△H=-437.3kJ•mol-1
(3)H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
依据盖斯定律计算,①-②-③得到固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式是:C(s)+H2O(g)=CO2(g)+H2(g)△H=-131.5kJ•mol-1;
故答案为:C(s)+H2O(g)=CO2(g)+H2(g)△H=-131.5kJ•mol-1.
点评 本题考查了热化学方程式的书写,题目难度中等,注意掌握热化学方程式的书写过程.

| A. | 氯化钠在火焰上灼烧时使火焰呈黄色,是因为氯化钠发生了分解反应 | |
| B. | 用焰色反应可以鉴别KCl和KNO3 | |
| C. | 连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 如透过蓝色的钴玻璃能够观察到紫色火焰,则肯定有K元素,可能有Na元素 |
(1)【提出假设】假设1:Fe2+还原性比I-强;假设2:I-还原性比Fe2+强;假设3:Fe2+和I-的还原性一样强.
【验证假设】
(2)利用以下装置进行试验
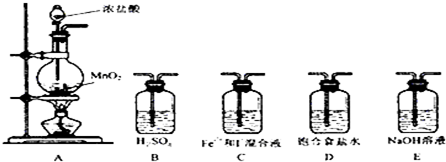
实验必需的装置是:A→C→E(按氯气流向的顺序用序号书写)
(3)实验开始后,控制通入少量氯气,通过观察溶液颜色的变化,不能(能或不能)判断反应的先后顺序.
(4)请在表中填写实验步骤及预期现象与结论.
| 实验步骤 | 预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加KSCN; 向B试管中滴加淀粉: | ①若A变红色, B不变色则假设1成立 ②若A不变色, B变蓝色则假设2成立 ③若A变红色, B变蓝色则假设3成立 |
(6)有同学质疑,上述实验只能验证氯气分别与Fe2+和I-反应的速率的大小.并不能证明Fe2+和I-的还原性强弱.于是提出另一验证方案:往KI溶液中滴加FeCl3溶液,如果能发生反应,就可证明二者的还原性强弱,该反应的离子方程式是2I-+2Fe3+=I2+2Fe2+.
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含40.0gNaOH的稀溶液与醋酸完全中和,放出57.3kJ的热量 | |
| C. | CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)的燃烧热的热方程式为2CO(g)+O2(g)=2CO2(g)△H=-283.0kJ/mol | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H=akJ/mol,2C(s)+O2(g)=2CO(g)△H=bkJ/mol,则b>a |
| A. | 新制的氯水呈黄绿色,久置的氯水无色 | |
| B. | 新制的氯水漂白作用强,而久置的氯水漂白作用很弱 | |
| C. | 新制的氯水所含成分的种类多,而久置的氯水所含成分的种类较少 | |
| D. | 新制的氯水中无氯离子,而久置的氯水中则含氯离子 |
| A. | 铝热反应,化学方程式为2Fe+Al2O3═2Al+Fe2O3 | |
| B. | 原电池是电能转化为化学能的装置 | |
| C. | 绿色植物的光合作用则实现了光能向化学能的转化 | |
| D. | 氯碱工业用电解饱和食盐水来制备氯气和火碱就是将化学能转化为电能 |
| A. | 氯气的摩尔质量是71 g/mol | |
| B. | 通过树状分类法可把硝酸和硫酸分入强酸,把纯碱分入正盐 | |
| C. | 酸性的雨水都是酸雨,酸雨的PH小于7 | |
| D. | 1mol CO2的质量是44 g |