题目内容
【题目】一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)![]() SiO2(s)+4HF(g)+148kJ
SiO2(s)+4HF(g)+148kJ
(1)写出该反应的平衡常数表达式:K=___________,若0~20min内,固体质量增加了6g,则20min内,用H2O表示该反应的平均速率是______________。
(2)下列各项中能说明该反应已达化学平衡状态的是_______(填字母序号)。
a. v正(SiF4)=4v逆(HF) b. c(SiF4):c(H2O)=1:2
c. 容器内气体的总质量不再变化 d. HF的体积分数不再变化
【答案】![]() 0.01mol/(Lmin) cd
0.01mol/(Lmin) cd
【解析】
![]() ,说明该反应是放热反应,分析时要注意二氧化硅的状态是固体。
,说明该反应是放热反应,分析时要注意二氧化硅的状态是固体。
(1)平衡常数等于生成物平衡浓度的系数次幂比反应物平衡浓度的系数次幂,固体和纯液体不列入平衡常数表达式,故该反应的平衡常数![]() ,固体质量增加了6g,说明生成了6g(0.1mol)二氧化硅,水的物质的量变化为0.2mol,
,固体质量增加了6g,说明生成了6g(0.1mol)二氧化硅,水的物质的量变化为0.2mol,![]() ,
,
故答案为:![]() ;0.01mol/(Lmin);
;0.01mol/(Lmin);
(2)
a.![]() ,正逆反应速率不相等,a错误;
,正逆反应速率不相等,a错误;
b.若初始加入量按照系数比加入,则![]() 始终等于1:2,不能说明达到平衡状态,b错误;
始终等于1:2,不能说明达到平衡状态,b错误;
c.因二氧化硅为固体, 所以容器内的气体总质量是一个变量,当它不再变化说明达到了平衡状态,c正确;
d.![]() 的体积分数是一个变量,当它不再变化说明达到了平衡状态,d正确;
的体积分数是一个变量,当它不再变化说明达到了平衡状态,d正确;
答案选cd。

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。
(一)CO2的化学捕获:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___(写含碳粒子符号)。(室温下,H2CO3的Ka1=4.3×10﹣7;Ka2=5.6×10﹣11)
(2)固体氧化物电解池(SOEC)用于高温共电解CO/H2,既可实现CO2的减排又可高效制备合成气(CO/H2),其工作原理如图。写出电极A发生的电极反应式___。

(二)CO2的综合利用
(1)CO2与CH4经催化重整制得合成气:
反应Ⅰ.CH4(g)H+CO2(g)2CO(g)+2H2(g)△H1
已知氢气、一氧化碳和甲烷的标准燃烧热(25℃)如表所示
物质 | H2(g) | CO(g) | CH4(g) |
标准燃烧热△H/kJmol﹣1 | ﹣285.8 | ﹣283.0 | ﹣890.3 |
则反应I的△H=___kJmol﹣1。
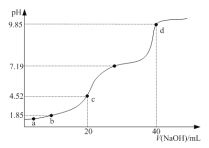
(2)用CO2催化加氢制取二甲醚的反应为:反应Ⅱ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),在10L恒容密闭容器中,均充入2mol CO2和6moH2,分别以铱(Ir)和铈(Ce)作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1。
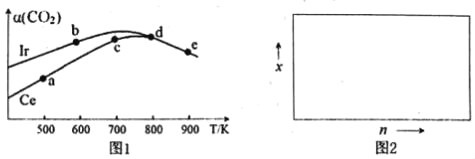
①根据图1,下列说法不正确的是___。
A.反应Ⅱ的△H<0,△S<0
B.用Ir和Ce作催化剂时,反应Ⅱ的活化能更低的是Ce
C.状态d时,v(正)<v(逆)
D.从状态b到d,α(CO2)先增大后减小,减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=___。
③若H2和CO2的物质的量之比为n:1,900K时相应平衡体系中二甲醚的物质的量分数为x,请在图2中绘制x随n变化的示意图。_______
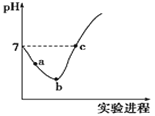
【题目】将0.1mol/LNa2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
(1)①时刻Na2SO3溶液中水的电离程度________同温下纯水中水的电离程度(填“>”、“<”或“=”);应用平衡原理解释该原因_______________________________。
(2)④的pH略小于①是由于_______________________________。