题目内容
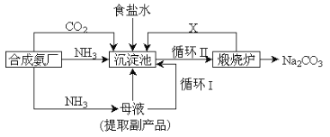
【题目】我国化学家侯德榜改革国外的纯碱生产工艺,创造了侯德榜制碱法又叫联碱法,该法是将合成氨工厂生产的NH3及副产品CO2,再与饱和食盐水反应.
(1)该法与氨碱法比大大提高了原料利用率,主要表现在_______。
(2)碳酸氢钠分解产生的二氧化碳可循环使用,但必须要补充,补充的主要原因是_________,但实际生产中补充量超过理论上反应耗用量,可能的原因是______。
(3)氨碱法需补充的二氧化碳一定来自_________。那么联合制碱需补充的二氧化碳可能来自__________。
(4)侯德榜法在滤去碳酸氢钠的母液中通氨气并加入细小食盐颗粒,冷却析出副产品,通氨气的作用____。
【答案】母液循环I提高了NaCl的利用率 生产过程中CO2有一半转化成碳酸根被产品碳酸钠所带走(碳酸根来自CO2),所以要补充; 在生产过程中还有损耗; 碳酸钙的分解; 合成氨生产中用水煤气法制原料氢气时的副产品; 增大NH4+的浓度,使NH4Cl更多地析出;使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
【解析】
合成氨工厂提供氨气及二氧化碳,通入饱和氯化钠溶液中,得到碳酸氢钠和副产物氯化铵,煅烧碳酸氢钠得到碳酸钠,同时产生的二氧化碳循环利用。
(1)对比该法与氨碱法可以发现侯德榜制碱法通过母液循环提高了氯化钠的利用率,
答案为:母液循环I提高了![]() 的利用率;
的利用率;
(2)根据元素守恒,制得碳酸钠肯定会消耗二氧化碳,有一部分二氧化碳可以循环利用,且工业生产中不可避免的会有一些损耗,故实际生产中补充量超过理论上反应耗用量,
答案为:生产过程中![]() 有一半转化成碳酸根被产品碳酸钠所带走(碳酸根来自
有一半转化成碳酸根被产品碳酸钠所带走(碳酸根来自![]() ),所以要补充;在生产过程中还有损耗;
),所以要补充;在生产过程中还有损耗;
(3)氨碱法补充二氧化碳来自碳酸钙分解,根据流程图,联合制碱需补充的二氧化碳来自于合成氨工厂,合成氨生产中用水煤气法制氢气时会产生副产品二氧化碳,
答案为:碳酸钙的分解;合成氨生产中用水煤气法制原料氢气时的副产品;
(4)向母液中通氨气的目的是为了提取更多更纯的氯化铵,
答案为:增大![]() 的浓度,使
的浓度,使![]() 更多地析出;使
更多地析出;使![]() 转化为
转化为![]() ,提高析出的
,提高析出的![]() 纯度。
纯度。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是![]() 时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是![]()
化学式 | AgCl |
|
| HClO |
|
Ksp或Ka |
|
|
|
|
|
A.相同浓度![]() 和NaClO的混合液中,各离子浓度的大小关系是
和NaClO的混合液中,各离子浓度的大小关系是![]()
B.向![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() :
:![]() :9,此时溶液
:9,此时溶液![]()
C.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
D.向浓度均为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀.
先形成沉淀.
【题目】I. 用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
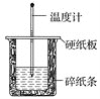
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)如果用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”)。
(3)实验时所用盐酸及NaOH溶液的体积均为50 mL,各溶液密度均为1 g·mL-1,生成溶液的比热容c=4.18 J·g-1·℃-1,实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式ΔH=________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”或“无影响”)。
II.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | VmL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中V1=________、T1=________;通过实验________(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=________。
(2)若t1<8,则由此实验可以得出的结论是________________________________


