题目内容
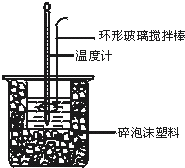 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)图中环形搅拌棒能否用铜质用品代替
(2)烧杯间填满碎纸条的作用是
(3)每一次平行实验至少需要观察记录几次温度数值
(4)大烧杯上如不盖硬纸板,求得的中和热数值
(5)实验中改用60mL 0.50mol?L-1盐酸跟50mL 0.55mol?L-1NaOH溶液进行反应,与上述实验相比,所求中和热
考点:中和热的测定
专题:实验题
分析:(1)根据金属棒是热的良导体,易传热;
(2)中和热测定实验成败的关键是保温工作;
(3)根据温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,混合反应后测最高温度;
(4)不盖硬纸板,会有一部分热量散失;
(5)根据中和热的概念和实质来回答.
(2)中和热测定实验成败的关键是保温工作;
(3)根据温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,混合反应后测最高温度;
(4)不盖硬纸板,会有一部分热量散失;
(5)根据中和热的概念和实质来回答.
解答:
解:(1)铜质搅拌棒的导热性好,易传热,散发热量,会使测出的温度偏低,所得中和热的测定值比理论值偏低,故答案为:不能;铜质搅拌棒易传热,散发热量,热量损失较大;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;
(3)温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,求出两者的平均值,混合反应后测最高温度,最后求出温度差,一共记录3次温度数,故答案为:3次;
(4)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(5)中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以改用60mL 0.50mol?L-1盐酸跟50mL 0.55mol?L-1NaOH溶液进行反应,与上述实验相比,所求中和热相等;
故答案为:相等;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;
(3)温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,求出两者的平均值,混合反应后测最高温度,最后求出温度差,一共记录3次温度数,故答案为:3次;
(4)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(5)中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以改用60mL 0.50mol?L-1盐酸跟50mL 0.55mol?L-1NaOH溶液进行反应,与上述实验相比,所求中和热相等;
故答案为:相等;
点评:本题考查学生中和热测定,保温工作是实验成功的关键,掌握实验原理即可解答,难度不大.

练习册系列答案
相关题目
Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2++2H2O?Fe(OH)2+2H+,往该溶液中滴加盐酸,发生的变化是( )
| A、平衡向逆反应方向移动 |
| B、平衡不移动 |
| C、溶液由浅绿色变成黄色 |
| D、溶液由浅绿色变为深绿色 |