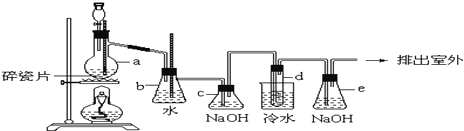
题目内容
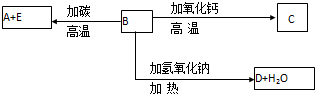
A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示.A为地壳含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似.
请填空:
(1)形成单质A的原子的结构示意图为 ,它的最高化合价为 .
(2)B的化学式(分子式)为 .B和碳反应生成A和E的化学方程式是 .
(3)C的化学式(分子式)为 ,D晶体中化学键类型有 .
(4)设计实验比较碳和A的非金属性强弱(用离子方程式表示) .

请填空:
(1)形成单质A的原子的结构示意图为
(2)B的化学式(分子式)为
(3)C的化学式(分子式)为
(4)设计实验比较碳和A的非金属性强弱(用离子方程式表示)
考点:无机物的推断
专题:推断题
分析:A、B、C、D、E代表单质或化合物,A为地壳含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似,则A为Si,B和碳在高温下反应生成硅,则B是SiO2,E是CO,高温下B和CaO反应生成C,则C是CaSiO3,二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,则D是Na2SiO3,再结合题目分析解答.
解答:
解:A、B、C、D、E代表单质或化合物,A为地壳含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似,则A为Si,B和碳在高温下反应生成硅,则B是SiO2,E是CO,高温下B和CaO反应生成C,则C是CaSiO3,二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,则D是Na2SiO3,
(1)A是Si,其原子核外有14个电子,原子结构示意图为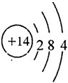 ,它的最高化合价为+4价,
,它的最高化合价为+4价,
故答案为: ;+4;
;+4;
(2)B为二氧化硅,其化学式为SiO2,高温下,二氧化硅和C反应生成CO和硅,反应方程式为,故答案为:SiO2;2C+SiO2
2CO↑+Si;
(3)C的化学式为CaSiO3,D 为 NaSiO3,其晶体中化学键类型有离子键、极性键,故答案为:CaSiO3;离子键、极性键;
(4)元素的非金属性越强,其最高价氧化物的水化物酸性越强,可以利用强酸制备弱酸的方法比较两者的非金属性的强弱,其离子方程式为SiO32-+CO2+H2O=H2SiO3+CO32-,
故答案为:SiO32-+CO2+H2O=H2SiO3+CO32-.
(1)A是Si,其原子核外有14个电子,原子结构示意图为
 ,它的最高化合价为+4价,
,它的最高化合价为+4价,故答案为:
 ;+4;
;+4;(2)B为二氧化硅,其化学式为SiO2,高温下,二氧化硅和C反应生成CO和硅,反应方程式为,故答案为:SiO2;2C+SiO2
| ||
(3)C的化学式为CaSiO3,D 为 NaSiO3,其晶体中化学键类型有离子键、极性键,故答案为:CaSiO3;离子键、极性键;
(4)元素的非金属性越强,其最高价氧化物的水化物酸性越强,可以利用强酸制备弱酸的方法比较两者的非金属性的强弱,其离子方程式为SiO32-+CO2+H2O=H2SiO3+CO32-,
故答案为:SiO32-+CO2+H2O=H2SiO3+CO32-.
点评:本题以Si为载体考查了硅及其化合物之间的转化,明确物质的性质是解本题关键,注意碳和二氧化硅反应生成二氧化碳而不是二氧化碳,为易错点.

练习册系列答案
相关题目
可以证明乙醇分子中有一个氢原子与另外的氢原子不同的是( )
| A、1mol乙醇燃烧生成3mol水 |
| B、1mol乙醇可以生成1mol乙醛 |
| C、1mol乙醇跟足量的金属作用得0.5mol H2 |
| D、乙醇可以制酒精饮料 |
分子式为C4H8O2的有机物在酸性条件下可水解为羧酸和醇,若不考虑立体结构,这些醇和羧酸重新组合可形成的酯共有( )
| A、4种 | B、11种 |
| C、12种 | D、13种 |
 实验室用乙醇和浓硫酸加热反应制取乙烯,其原理为:
实验室用乙醇和浓硫酸加热反应制取乙烯,其原理为: 按要求完成下列两题:
按要求完成下列两题: