题目内容
(5分)实验室用8.7g的MnO2与足量的浓盐酸制取氯气:求生成氯气的体积(标准状况)和被氧化的HCl的物质的量。
(5分)
MnO2+4HCl=Mn Cl2+Cl2↑+2H2O 被氧化的HCl
87 22.4 2
8.7 V (Cl2) n(HCl)
V (Cl2)="2.24L "
n(HCl)=0.2mol
MnO2+4HCl=Mn Cl2+Cl2↑+2H2O 被氧化的HCl
87 22.4 2
8.7 V (Cl2) n(HCl)
V (Cl2)="2.24L "
n(HCl)=0.2mol
略

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目

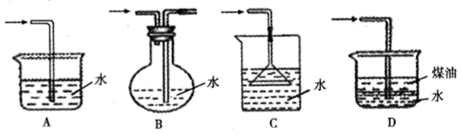


 NaHSO4+HNO3↑,制取HNO3时,下图所列装置中最适合的是
NaHSO4+HNO3↑,制取HNO3时,下图所列装置中最适合的是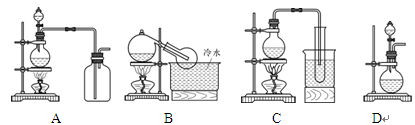


 mL D.200mL
mL D.200mL ▲ 。
▲ 。 水至刻度处
水至刻度处