题目内容
【题目】室温下,向0.01 mol·L1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如右图所示。下列分析正确的是( )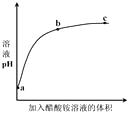
A.a点,pH = 2
B.b点,c(CH3COO-) > c(NH4+)
C.c点,pH可能大于7
D.ac段,溶液pH增大是CH3COOH ![]() H+ + CH3COO-逆向移动的结果
H+ + CH3COO-逆向移动的结果
【答案】B
【解析】A.醋酸是弱酸,0.01 mol·L1的醋酸溶液的pH > 2,故A不符合题意;
B.b点为醋酸和醋酸铵的混合溶液,溶液显酸性,pH逐渐接近7,根据电荷守恒,c(CH3COO-) + c(OH-)= c(NH4+)+ c(H+),因此c(CH3COO-) > c(NH4+),故B符合题意;
C.酸性溶液和中性溶液混合,不可能变成碱性,故C不符合题意;
D.ac段,相当于醋酸溶液的稀释,稀释过程中,CH3COOH ![]() H+ + CH3COO-正向移动,但c(H+)减小,故D不符合题意。
H+ + CH3COO-正向移动,但c(H+)减小,故D不符合题意。
所以答案是:B
【考点精析】认真审题,首先需要了解弱电解质在水溶液中的电离平衡(当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理).

【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应的措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇(CH3OH,液态)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: .
(2)已知化学键的键能为:
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | 391 | 945 |
又知反应N2(g)+3H2(g)2NH3(g)△H=a kJmol﹣1 . 试根据表中所列键能数据估算a的值为 .
(3)已知:C(s,石墨)+O2(g)═CO2(g)△H=﹣393kJmol﹣1
2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2599kJmol﹣1
根据盖斯定律,计算 298K时C(s,石墨)和H2(g)反应生成1mol C2H2(g)的焓变为 .