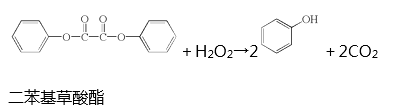题目内容
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极. 
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
①电源的N端为极;
②电极b上发生的电极反应为;
③列式计算电极b上生成的气体在标准状况下的体积:
④电极c的质量变化是g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液;
乙溶液;
丙溶液;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? .
【答案】
(1)正;4OH﹣﹣4e﹣=2H2O+O2↑;2.8L;16;甲增大,因为相当于电解水;乙减小,OH﹣放电,H+增多;丙不变,相当于电解水
(2)可以,铜全部析出,可以继续电解H2SO4 , 有电解液即可电解
【解析】解:(1)①乙杯中c质量增加,说明Cu沉积在c电极上,电子是从b﹣c移动,M是负极,N为正极,所以答案是:正极;②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH﹣放电,即4OH﹣﹣4e﹣=2H2O+O2↑,所以答案是:4OH﹣﹣4e﹣=2H2O+O2↑;③丙中为K2SO4 , 相当于电解水,设电解的水的质量为x.由电解前后溶质质量相等有,100×10%=(100﹣x)×10.47%,得x=4.5g,故为0.25mol.由方程式2H2+O2═2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L,所以答案是:答案2.8L; ④整个电路是串联的,所以每个烧杯中的电极上转移电子数是相等的,根据电极反应:Cu2++2e﹣=Cu,可知转移0.5mol电子生成的m(Cu)= ![]() ×64=16g,所以答案是:16;⑤甲中相当于电解水,故NaOH的浓度增大,pH变大.乙中阴极为Cu2+放电,阳极为OH﹣放电,电解方程式为:2CuSO4+2H2O
×64=16g,所以答案是:16;⑤甲中相当于电解水,故NaOH的浓度增大,pH变大.乙中阴极为Cu2+放电,阳极为OH﹣放电,电解方程式为:2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4 , 所以H+增多,故pH减小.丙中为电解水,对于K2SO4而言,其pH几乎不变.所以答案是:甲增大,因为相当于电解水;乙减小,OH﹣放电,H+增多.丙不变,相当于电解水;(2)当铜全部析出时,溶液中仍有电解质硫酸,可以继续电解,所以答案是:可以; 铜全部析出,可以继续电解H2SO4 , 有电解液即可电解.
2Cu+O2↑+2H2SO4 , 所以H+增多,故pH减小.丙中为电解水,对于K2SO4而言,其pH几乎不变.所以答案是:甲增大,因为相当于电解水;乙减小,OH﹣放电,H+增多.丙不变,相当于电解水;(2)当铜全部析出时,溶液中仍有电解质硫酸,可以继续电解,所以答案是:可以; 铜全部析出,可以继续电解H2SO4 , 有电解液即可电解.

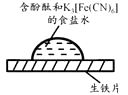
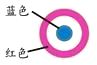
【题目】某同学进行下列实验:( )
操作 | 现象 |
|
|
下列说法不合理的是
A.生铁片发生吸氧腐蚀
B.中心区:Fe–2e-=Fe2+
C.边缘处:O2+2H2O+4e-=4OH-
D.交界处:4Fe2++O2+10H2O=4Fe(OH)3+8H+