题目内容
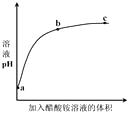
【题目】新制氢氧化铜存在平衡:Cu(OH)2 + 2OH—![]() Cu(OH)42—(深蓝色)。某同学进行下列实验:( )
Cu(OH)42—(深蓝色)。某同学进行下列实验:( )
下列说法不正确的是
A.①中出现蓝色沉淀
B.③中现象是Cu(OH)2 + 2OH—![]() Cu(OH)42—正向移动的结果
Cu(OH)42—正向移动的结果
C.④中现象证明葡萄糖具有还原性
D.对比②和④可知Cu(OH)2氧化性强于Cu(OH)42—
【答案】D
【解析】A. ①中氢氧化钠与硫酸铜反应生成氢氧化铜蓝色沉淀,故A不符合题意;
B. ③中溶液呈深蓝色,是因为加入了氢氧化钠,Cu(OH)2 + 2OH-![]() Cu(OH)42-正向移动,故B不符合题意;
Cu(OH)42-正向移动,故B不符合题意;
C. ④中新制的氢氧化铜悬浊液与葡萄糖发生氧化还原反应,生成了氧化亚铜沉淀,体现了葡萄糖的还原性,故C不符合题意;
D. ②无氧化亚铜沉淀生成,是因为氢氧化钠太少,溶液碱性太弱,反应没有进行,故D符合题意。
所以答案是:D
【考点精析】掌握氧化性、还原性强弱的比较和醛类简介是解答本题的根本,需要知道金属阳离子的氧化性随其单质还原性的增强而减弱;非金属阴离子的还原性随其单质的氧化性增强而减弱;不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强;当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强;烃基与醛基结合着的化台物叫做醛:R—CHO.

【题目】某温度下,反应 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(molL﹣1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是( )
A.CH3OH的起始浓度为1.04mol/L
B.此时逆反应速率大于正反应速率
C.平衡时CH3OH的浓度为0.04mol/L
D.平衡时CH3OH的转化率小于80%