题目内容
【题目】下列物质中,含有共价键的离子化合物的是
A.Na2OB.MgCl2C.NaOHD.H2O
【答案】C
【解析】
由离子键构成的化合物称为离子化合物,由共价键构成的化合物称为共价化合物。
A.Na2O属于离子化合物,只含离子键,不含共价键,A不符合题意;
B.MgCl2属于离子化合物,只含离子键,不含共价键,B不符合题意;
C.NaOH含有共价键和离子键,属于含有共价键的离子化合物,C符合题意;
D.H2O属于共价化合物,只含有共价键,D不符合题意。
答案选C。

 字词句段篇系列答案
字词句段篇系列答案【题目】CO、CO2是含碳元素的常见气体,也是参与碳循环的重要物质。研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0 kJ·mol-1;
C(s) +CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为______________________________。
(2)甲醇是重要的化工原料,利用煤化工中生产的CO和H2可制取甲醇,发生的反应为CO(g)+2H2(g) ![]() CH3OH(g)。实验室中,在1L恒容的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
CH3OH(g)。实验室中,在1L恒容的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
10min | 20min | 30min | 40min | 50min | 60min | |
300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
①300℃和500℃对应的平衡常数大小关系为K300℃_________K500℃(填“>”、“=”或“<”)。
②下列关于该反应的说法正确的是______________(填选项字母,下同)
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.温度一定时,压强不再随时间变化可以说明反应达到了平衡状态
D.使用高效催化剂,ΔH会增大
③300 ℃时,前10 min内,该反应的平均反应速率为v(H2)=___mol/(L·min)。
④下列措施能够增大此反应中CO的转化率的是_________。
A. 充入CO气体 B. 升高温度
C. 使用优质催化剂 D. 往容器中再充入1 mol CO和2 mol H2
⑤500 ℃时,保持反应体系的温度不变,60min时再向容器中充入CH3OH气体和H2各0.4mol,反应将向___(填“正反应方向”、“逆反应方向”或“不”)进行。再次达到平衡时的平衡常数为____________L2/mol2。
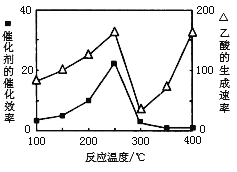
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见下图。当乙酸的生成速率主要取决于温度时,其影响范围是__________________。