题目内容
【题目】某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1moLL﹣1NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为( )
A.1:1:1
B.2:2:1
C.2:1:1
D.1:1:2
【答案】B
【解析】假定NaOH溶液的浓度为cmol/L,则:
根据图象知,横坐标为0﹣10mL时发生的反应是:H++OH﹣=H2O,加入10mLNaOH溶液结合中和氢离子,n(H+)=n(NaOH)=0.01L×cmol/L=0.01cmol;
横坐标为50﹣60mL时,发生的化学反应是:Al(OH)3+OH﹣=AlO2﹣+2H2O,Al(OH)3完全溶解消耗消耗10mLNaOH溶液,由方程式可知n[Al(OH)3]=n(NaOH)=0.01L×cmol/L=0.01c,再根据铝元素守恒可知,n(Al3+)=n[Al(OH)3]=0.01cmol;
横坐标为10﹣50mL时发生的化学反应是:Mg2++2OH﹣=Mg(OH)2↓、Al3++3OH﹣=Al(OH)3↓,沉淀为最大值时,该阶段消耗40mLNaOH溶液,根据OH﹣守恒,2n[Mg(OH)2]+3n[Al(OH)3]=n(NaOH),故2n[Mg(OH)2]+0.03c=0.04L×cmol/L,故n[Mg(OH)2]=0.005cmol,则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为0.01c:0.01c:0.005c=2:2:1,
故答案为:B.
开始没有沉淀生成发生了断键中和反应,据此计算氢离子的物质的量;沉淀量达到最大值后溶解是因为氢氧化铝与氢氧化钠的反应,据此计算吕磊床额物质的量;最后根据沉淀的最大值计算镁离子的物质的量即可.

【题目】C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元索周期表第周期第族.
(2)N原子的原子结构示意图为;Cu的低价氧化物的颜色为 .
(3)用“>”或“<”填空:
原子半径 | 电负性 | 熔点 | 沸点 |
AlSi | NO | 金刚石晶体硅 | CH4SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生.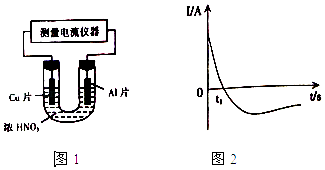
0﹣t1时,原电池的负极是Al片,此时,正极的电极反应式是 , 溶液中的H+向极移动,t1时,原电池中电子流动方向发生改变,其原因是 .