题目内容
【题目】下表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空。
族 周期 | ⅠA | 0 | ||||||||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||||||
2 | X | Y | G | |||||||||||
3 | Z | …… | H | W | E | Q | ||||||||
(1)上述元素的原子中,得电子能力最强的是______________(填元素名称)。
2)化学性质最不活泼的是___________(填元素符号)。
(3)G对应离子的半径______________Z对应离子的半径(填“<”或“>”)。
(4)写出H与Z的最高价氧化物的水化物溶液反应的离子方程式:________________。
(5)元素X的最高价氧化物的电子式________________,元素W的最高价氧化物为
_______________(填晶体类型)。
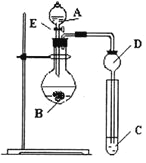
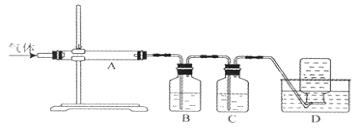
(6)为比较元素X和W的非金属性强弱,用下图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B的作用是________________,能说明X和W非金属性强弱的化学方程式是_________________________________。

【答案】 氟 Ar ﹥ 2Al + 2OH- +2H2O = 2AlO2-+ 3H2↑ ![]() 原子晶体 吸收CO2中的HCl气体 CO2 + H2O + Na2SiO3 = Na2CO3 + H2SiO3↓
原子晶体 吸收CO2中的HCl气体 CO2 + H2O + Na2SiO3 = Na2CO3 + H2SiO3↓
【解析】由元素在周期表在的位置可知,X为C,Y为N,G为F,Z为Na,H为Al,W为Si,E为Cl,Q为Ar。(1)上述元素中F(氟)的非金属性最强,得电子能力最强;(2)化学性质最不活泼的是Ar;(3)具有相同排布的离子,原子序数大的离子半径小,则Z的原子序数大,其离子半径小,所以G对应离子的半径>Z对应离子的半径;(4)Z的最高价氧化物对应水化物为NaOH,与Al反应生成偏铝酸钠和氢气,反应的离子反应为2Al+2OH﹣+2H2O═2AlO2﹣+2H2↑;(5)元素X的最高价氧化物CO2,其电子式为:![]() ;元素W的最高价氧化物为SiO2,属于原子晶体;(6)比较元素X和W的非金属性强弱,图中装置中发生强酸制取弱酸的反应原理,B中试剂吸收二氧化碳中的HCl,说明X和W非金属性强弱,则装置中最后的试剂瓶中发生二氧化碳与硅酸钠的反应生成硅酸,化学方程式为CO2 + H2O + Na2SiO3 = Na2CO3 + H2SiO3↓。
;元素W的最高价氧化物为SiO2,属于原子晶体;(6)比较元素X和W的非金属性强弱,图中装置中发生强酸制取弱酸的反应原理,B中试剂吸收二氧化碳中的HCl,说明X和W非金属性强弱,则装置中最后的试剂瓶中发生二氧化碳与硅酸钠的反应生成硅酸,化学方程式为CO2 + H2O + Na2SiO3 = Na2CO3 + H2SiO3↓。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案