题目内容
【题目】下列关于化学反应与能量的说法正确的是 ( )
A. 放热反应在常温下一定很容易发生
B. 化学反应一定既伴随着物质变化又伴随着能量变化
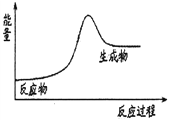
C. 石灰石分解反应的能量变化可以用右图3表示
D. 反应物所具有的总能量高于生成物所具有的总能量的反应为吸热反应
【答案】BC
【解析】A、放热的反应在常温下不一定很容易发生,如:铝热反应2 Al+Fe2O3Al2O3+2Fe是放热反应,但需在高温条件下以保证足够的热量引发氧化铁和铝粉反应,选项A错误;B、反应物和产物的总能量是不一样的,其能量差值就是反应热。所以化学变化一定伴随物质变化和能量变化,选项B正确;C、图3表示反应物的总能量低于生成物的总能量,为吸热反应,石灰石分解是吸热反应,选项C正确;D、反应物所具有的总能量高于生成物所具有的总能量的反应为放热反应,选项D错误。答案选BC。

【题目】下表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空。
族 周期 | ⅠA | 0 | ||||||||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||||||
2 | X | Y | G | |||||||||||
3 | Z | …… | H | W | E | Q | ||||||||
(1)上述元素的原子中,得电子能力最强的是______________(填元素名称)。
2)化学性质最不活泼的是___________(填元素符号)。
(3)G对应离子的半径______________Z对应离子的半径(填“<”或“>”)。
(4)写出H与Z的最高价氧化物的水化物溶液反应的离子方程式:________________。
(5)元素X的最高价氧化物的电子式________________,元素W的最高价氧化物为
_______________(填晶体类型)。
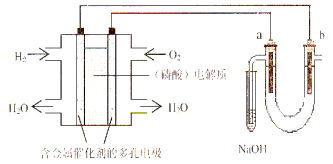
(6)为比较元素X和W的非金属性强弱,用下图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B的作用是________________,能说明X和W非金属性强弱的化学方程式是_________________________________。