题目内容
【题目】(1)一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),CH3OH(g) + H2O(g)![]() CO2(g) + 3H2(g)
CO2(g) + 3H2(g) ![]() H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的 倍。
②该条件下反应达平衡状态的依据是(填序号) 。
A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热Q kJ。则表示甲醇燃烧热的热化学方程式为_____________________。
(3)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
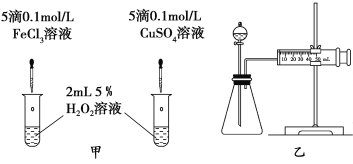
①定性分析:如图甲可通过观察__________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___________。
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是 ,实验中需要测量的数据是___________________。
【答案】(1)①1.2 ②D
(2)CH3OH(l)+3/2O2(g)![]() CO2(g)+2H2O(l)ΔH=-32QkJ·mol-1
CO2(g)+2H2O(l)ΔH=-32QkJ·mol-1
(3)①反应产生气泡的快慢;控制阳离子相同,排除阴离子的干扰;
②关闭分液漏斗活塞,将注射器活塞向外拉出一定距离,一段时间后松开,观察活塞是否回到原位。收集40mL气体所需时间
【解析】
试题分析:

1mol---49.4 kJ ,放热19.76 kJ,消耗CH3OH 的量 X=0.4mol.,剩余各物质的量:甲醇0.6 mol, 水2.6 mol 二氧化碳0.4 mol 氢气1.2mol;气体的压强之比与气体的物质的量成正比:反应后:0.6+2.6+0.4+1.2=4.8 mol,反应前:1+3=4 mol,4.8/4=1.2;
(2)该条件下反应达平衡状态的依据是V 正=V逆,v正(CH3OH)=v正(CO2),同向,无法判断;容器的体积不变,反应前后气体的质量不变,密度为定值。无法判断;该反应为反应前后体积可变的反应,混合气体的总物质的量不变,反应达平衡状态。
(3)1 g CH3OH燃烧生成液态水时放热Q kJ。则1摩尔CH3OH燃烧生成液态水时放热32Q kJ则表示甲醇燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH=-32QkJ·mol-1;
CO2(g)+2H2O(l) ΔH=-32QkJ·mol-1;
(3)双氧水在催化剂作用下,分解产生氧气,因此可以观察反应产生气泡的快慢;为了便于比较催化效率,阳离子不同,阴离子一样,便于比较。
(4)检查该装置气密性的方法是:形成密闭体系,造成压强差;检验时均以生成40 mL气体为准,那么就测量收集40 mL气体所需要的时间长短。不同的催化剂催化能力不同,所需时间不同。

【题目】下表中物质的分类组合完全正确的是
编 号 | A | B | C | D |
强电解质 | KNO3 | H2SO4 | Ba(OH)2 | BaSO4 |
弱电解质 | CH3COOH | CaCO3 | H2S | NH3·H2O |
非电解质 | SO2 | CO2 | Cl2 | C2H5OH溶液 |
A. A B. B C. C D. D
【题目】下表列出了部分元素在周期表中的位置,请用具体的元素完成下列填空。
族 周期 | ⅠA | 0 | ||||||||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||||||||
2 | X | Y | G | |||||||||||
3 | Z | …… | H | W | E | Q | ||||||||
(1)上述元素的原子中,得电子能力最强的是______________(填元素名称)。
2)化学性质最不活泼的是___________(填元素符号)。
(3)G对应离子的半径______________Z对应离子的半径(填“<”或“>”)。
(4)写出H与Z的最高价氧化物的水化物溶液反应的离子方程式:________________。
(5)元素X的最高价氧化物的电子式________________,元素W的最高价氧化物为
_______________(填晶体类型)。
(6)为比较元素X和W的非金属性强弱,用下图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B的作用是________________,能说明X和W非金属性强弱的化学方程式是_________________________________。

