题目内容
【题目】熔融碳酸盐燃料电池,是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池.其电解质是熔融态碳酸盐.如图是用熔融碳酸盐作电解质,氢气和氧气形成的燃料电池,下列说法不正确的是( ) 
A.该电池放电时,负极的反应式为:H2﹣2e﹣+CO32﹣═H2O+CO2
B.该电池中CO32﹣的为由左边移向右边移动
C.该电池放电时,正极的反应式为:O2+2CO2+4e﹣═2CO32﹣
D.该电池放电时,当转移4mol e﹣时正极消耗1mol O2和2mol CO2
【答案】B
【解析】解:该燃料电池中,通入燃料氢气的电极是负极,通入氧化剂氧气的电极是正极,负极反应式为H2﹣2e﹣+CO32﹣=CO2+H2O,正极反应式为O2+2CO2+4e﹣═2CO32﹣ , A.放电时负极反应式为H2﹣2e﹣+CO32﹣=CO2+H2O,故A正确;
B.放电时,电解质中阴离子向负极移动,阳离子向正极移动,所以碳酸根离子由右向左移动,故B错误;
C.该电池放电时,正极上氧气得电子和二氧化碳反应生成碳酸根离子,所以正极的反应式为:O2+2CO2+4e﹣═2CO32﹣ , 故C正确;
D.该电池放电时,根据O2+2CO2+4e﹣═2CO32﹣知,当转移4mol e﹣时,正极消耗1mol O2和2mol CO2 , 故D正确;
故选B.

练习册系列答案
相关题目
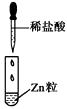
【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有白色沉淀生成,溶液为蓝色 | 有无色气体放出 |
以下结论正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为CuCl2
C.Ⅲ中的离子方程式为2H++Zn=Zn2++H2↑
D.Ⅲ中发生的反应不是离子反应