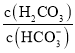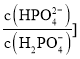题目内容
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-△H>0,下列叙述正确的是( )
H++OH-△H>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体亚硫酸氢钠,c(H+)增大,水的电离程度增大
C.由水电离出的c(H+)=1×10-12mol/L的溶液pH一定为12
D.将水加热,Kw增大,pH减小
【答案】D
【解析】
A. 向水中加入氨水,溶液由中性到碱性,碱对水的电离起抑制作用,所以平衡逆向移动,但c(OH-)增大,故A错误;
B. NaHSO3在溶液中电离大于水解,电离出的氢离子使溶液中c(H+)增大,溶液呈酸性,H+使水的电离平衡向右移动,水的电离程度减小,故B错误;
C. 在25℃时水的离子积常数是1×10-14,某溶液中由水电离出的c(H+)=1×10-12mol/L,水的电离受到了抑制,可能是外加酸,也可能是外加碱,若外加酸,则溶液中c(H+)=1×10-14÷1×10-12=1×10-2mol/L,pH=2;若外加碱,则c(H+)=1×10-12mol/L,pH=12,故C错误;
D. 水的电离是吸热过程,加热后平衡向电离方向移动,H+与OH-的浓度增大,水的离子积常数Kw增大,溶液中PH减小,故D正确;
故选D。

 阳光课堂课时优化作业系列答案
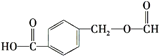
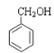
阳光课堂课时优化作业系列答案【题目】乙二酸俗称草酸![]() 结构简式为
结构简式为![]() ,可简写为
,可简写为![]() ,它是一种重要的化工原料.
,它是一种重要的化工原料.![]() 常温下
常温下![]() 的
的![]() 、
、![]() 、
、![]() 溶液的pH如表所示.
溶液的pH如表所示.![]()
|
|
| |
pH |
|
|
|
填空:
![]() 写出
写出![]() 的电离方程式______.
的电离方程式______.
![]() 溶液显酸性的原因是______;向
溶液显酸性的原因是______;向![]() 的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
a.![]()
![]()
![]()
![]()
![]() 与酸性高锰酸钾溶液反应,现象是有气泡
与酸性高锰酸钾溶液反应,现象是有气泡![]() 产生,紫色消失。写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是______.
产生,紫色消失。写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是______.
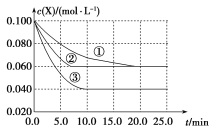
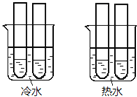
![]() 某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL
某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL![]()
![]()
![]() 溶液和4mL
溶液和4mL![]() 酸性
酸性![]() 溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究______,但该实验始终没有看到溶液褪色,推测原因______.
溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究______,但该实验始终没有看到溶液褪色,推测原因______.
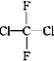
![]() 已知草酸
已知草酸![]() 受热分解的化学方程式为:
受热分解的化学方程式为:![]() ,写出
,写出![]() 在密闭容器中高温分解的化学方程式______.
在密闭容器中高温分解的化学方程式______.