题目内容
12.下列反应中:其中氧化剂中只有$\frac{1}{4}$被还原的是(1)3Cl2+8NH3═6NH4Cl+N2
(2)Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O
(3)3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(4)KClO3+6HCl═KCl+3Cl2↑+3H2O( )
| A. | (1)、(4) | B. | 只有(3) | C. | 只有(2) | D. | (1)(2)(3)(4) |
分析 (1)3Cl2+8NH3═6NH4Cl+N2,Cl元素的化合价由0价降低为-1价;
(2)Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,N元素的化合价由+5价降低为+4价;
(3)3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,N元素的化合价由+5价降低为+2价;
(4)KClO3+6HCl═KCl+3Cl2↑+3H2O,Cl元素的化合价由+5价降低为0价.
解答 解:(1)3Cl2+8NH3═6NH4Cl+N2,Cl元素的化合价由0价降低为-1价,则氧化剂中都被还原,故错误;
(2)Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,N元素的化合价由+5价降低为+4价,则4molHNO3中2mol被还原,故错误;
(3)3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,N元素的化合价由+5价降低为+2价,则8molHNO3中2mol被还原,所以氧化剂中只有$\frac{1}{4}$被还原,故正确;
(4)KClO3+6HCl═KCl+3Cl2↑+3H2O,Cl元素的化合价由+5价降低为0价,则氧化剂中都被还原,故错误;
故选:B.
点评 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,题目难度中等.

练习册系列答案
相关题目
7.含有大量Ba2+、OH-、NO3-的溶液中还可能大量存在的离子是( )
| A. | Na+ | B. | H+ | C. | SO42- | D. | Mg2+ |
17.FeSO4•7H2O广泛用于医药和工业领域,实验室制备FeSO4•7H2O的流程如下:
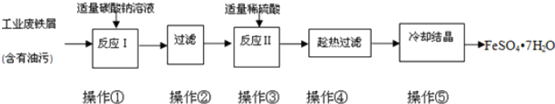
(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是除去废铁屑表面的油污.
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②降低FeSO4在水中的溶解度,减少FeSO4•7H2O的损耗.
(3)FeSO4•7H2O是某些补血剂的主要成分,将1.5g某补血剂预处理,配成100mL溶液.实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5g)中铁元素的含量,
①配制100mL 1.200×10 -2mol•L-1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是用玻璃棒引流,玻璃棒底部要在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是c.
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在酸式滴定管中.滴定到终点时的现象为滴入最后一滴KMnO4溶液,恰好变为紫红色,且半分钟内不退色.
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下.
该补血剂中铁元素的质量分数为16.8%.

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是除去废铁屑表面的油污.
(2)最后得到的绿矾晶体用少量冰水洗涤,其目的:①除去晶体表面附着的硫酸等杂质;②降低FeSO4在水中的溶解度,减少FeSO4•7H2O的损耗.
(3)FeSO4•7H2O是某些补血剂的主要成分,将1.5g某补血剂预处理,配成100mL溶液.实验室用KMnO4溶液通过氧化还原滴定测定该补血剂(1.5g)中铁元素的含量,
①配制100mL 1.200×10 -2mol•L-1的KMnO4溶液时,将溶解后的溶液转移至容量瓶中的操作方法是用玻璃棒引流,玻璃棒底部要在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口
②实验中的KMnO4溶液需要酸化,可用于酸化的酸是c.
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
KMnO4溶液应盛装在酸式滴定管中.滴定到终点时的现象为滴入最后一滴KMnO4溶液,恰好变为紫红色,且半分钟内不退色.
③滴定完毕,三次实验记录KMnO4标准溶液的读数如下.
| 滴定次数实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
4.下列各组溶液,只用试管和胶头滴管,不用任何试剂就可以鉴别的是( )
| A. | H2SO4和NaHCO3 | B. | KOH和Al2(SO4)3 | C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
1. 乙二酸( HOOC-COOH)俗称草酸,它广泛分布于植物的茎叶中.为了探究乙二酸的性质.某化学兴趣小组设计了如下实验,试根据所给信息,回答有关问题:
乙二酸( HOOC-COOH)俗称草酸,它广泛分布于植物的茎叶中.为了探究乙二酸的性质.某化学兴趣小组设计了如下实验,试根据所给信息,回答有关问题:
I.乙二酸的弱酸性:
查数据可知(25℃):
(1)H2C2O4的电离方程式为H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-.
(2)向盛有饱和NaHCO3溶液的试管里加入少量草酸溶液,可观察到有无色气泡产生,该反应的离子方程式为2HCO3-+H2C2O4=C2O42-+2H2O+2CO2↑.
(3)该小组同学将0.1mol•L-1草酸溶液和0.1mol•L-1的NaOH等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(4)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是AD.
A.测0.1mol•L-1草酸溶液的pH B.将草酸溶液加入Na2CO3溶液中,有CO2放出
C.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色 D.测草酸钠溶液的pH
Ⅱ.一定温度下,草酸晶体加水稀释过程中溶液的导电能力曲线如图所示:
(1)下列有关草酸稀释的说法正确的是A
A.a、b、c三点草酸的电离程度:a<b<c
B.a、b、c三点溶液的pH:c<a<b
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏大
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
(2)在上述稀释过程中,始终保持增大趋势的是BD
A.溶液PH值 B.草酸电离度α C.c(H+)•c(OH-) D.C2O42-个数
Ⅲ.已知草酸的钠盐和钾盐易溶于水,而其钙盐却难溶于水.查数据可知:CaCO3、CaC2O4的溶度积常数Ksp(25℃)分别为5.0×10-9、2.5×10-9,向0.6mol•L-1Na2C2O4溶液中加入过量CaCO3固体后,溶液中的c(CO32-)=0.4mol/L.
 乙二酸( HOOC-COOH)俗称草酸,它广泛分布于植物的茎叶中.为了探究乙二酸的性质.某化学兴趣小组设计了如下实验,试根据所给信息,回答有关问题:
乙二酸( HOOC-COOH)俗称草酸,它广泛分布于植物的茎叶中.为了探究乙二酸的性质.某化学兴趣小组设计了如下实验,试根据所给信息,回答有关问题:I.乙二酸的弱酸性:
查数据可知(25℃):
| 弱酸 | 电离常数 | 弱酸 | 电离常数 |
| H2CO3 (碳酸) | K1=4.4×10-7 | H2C2O4 (草酸) | K1=5.4×10-2 |
| K2=4.7×10-11 | K2=5.4×10-5 |
(2)向盛有饱和NaHCO3溶液的试管里加入少量草酸溶液,可观察到有无色气泡产生,该反应的离子方程式为2HCO3-+H2C2O4=C2O42-+2H2O+2CO2↑.
(3)该小组同学将0.1mol•L-1草酸溶液和0.1mol•L-1的NaOH等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(4)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是AD.
A.测0.1mol•L-1草酸溶液的pH B.将草酸溶液加入Na2CO3溶液中,有CO2放出
C.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色 D.测草酸钠溶液的pH
Ⅱ.一定温度下,草酸晶体加水稀释过程中溶液的导电能力曲线如图所示:
(1)下列有关草酸稀释的说法正确的是A
A.a、b、c三点草酸的电离程度:a<b<c
B.a、b、c三点溶液的pH:c<a<b
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏大
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
(2)在上述稀释过程中,始终保持增大趋势的是BD
A.溶液PH值 B.草酸电离度α C.c(H+)•c(OH-) D.C2O42-个数
Ⅲ.已知草酸的钠盐和钾盐易溶于水,而其钙盐却难溶于水.查数据可知:CaCO3、CaC2O4的溶度积常数Ksp(25℃)分别为5.0×10-9、2.5×10-9,向0.6mol•L-1Na2C2O4溶液中加入过量CaCO3固体后,溶液中的c(CO32-)=0.4mol/L.
2.有铝片、铁片、铜片三种金属片,只利用下列某种试剂或方法无法将它们区别开的是( )
| A. | 盐酸 | B. | 醋酸 | C. | NaOH溶液 | D. | 观察法 |
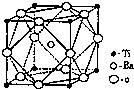 钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题: