题目内容
下列说法正确的是( )
| A.如果反应是放热的,则不需要加热反应就会发生 |
| B.合成氨反应中使用催化剂,能使原来不能发生的反应变成可发生的反应 |
C.反应2NO2 N2O4在恒容容器中进行,当体系压强不再发生变化时,反应达到化学平衡状态 N2O4在恒容容器中进行,当体系压强不再发生变化时,反应达到化学平衡状态 |
D.对于反应2SO2 + O2 2SO3 ,2 mol SO2与足量O2反应能生成2 mol SO3 2SO3 ,2 mol SO2与足量O2反应能生成2 mol SO3 |
C
A不正确,反应条件与反应是放热反应还是吸热反应无关。B不正确,催化剂只能改变能发生反应的反应速率。在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,由于选项C中反应是体积减小的可逆反应,所以当压强不再发生变化时,可以说明已经达到平衡状态,C正确。D不正确,因为是可逆反应,其转化率达不到100%,答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 C(g)+D(g)已达到平衡的是
C(g)+D(g)已达到平衡的是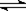 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是 ( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是 ( )
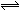 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示,符合图示正确的是 ( )
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示,符合图示正确的是 ( )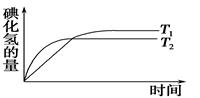
 N2 + 3H2,在某温度下的平衡常数为0.25,那么,在此条件下,氨的合成反应1/2 N2 + 3/2 H2
N2 + 3H2,在某温度下的平衡常数为0.25,那么,在此条件下,氨的合成反应1/2 N2 + 3/2 H2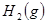 和
和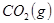 ,发生反应
,发生反应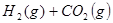
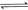
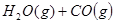 ,其起始浓度如下表所示。测得平衡时甲中
,其起始浓度如下表所示。测得平衡时甲中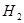 的转化率是60%。下列判断正确的是
的转化率是60%。下列判断正确的是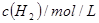
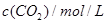
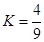
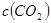 是甲中的2倍
是甲中的2倍 CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )
CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )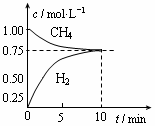
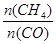 增大
增大
 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表: