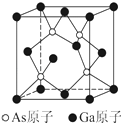
题目内容
【题目】某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:

(1)实验室制备Cl2的离子方程式是_____________________________,应选用上图A、E装置中的______(填序号)制Cl2,反应中浓盐酸所表现出的性质是_________________。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是___________________________________。
(3)装置C的作用是____________________________________。
(4)甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析:

①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是_____________________。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是(用相应的离子方程式作答)____________
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,原因是_______________________________________________。
【答案】 MnO2+4H++2Cl-![]() Mn2++2H2O +Cl2↑ E 酸性和还原性 溶液由无色变为红色 吸收多余的氯气和二氧化硫 使两种气体充分混合;通过观察气泡的速度控制气体流量,使二者按一定比列混合 2SO2+Cl2 +2H2O=4H++SO42-+2Cl- SO2和Cl2的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性
Mn2++2H2O +Cl2↑ E 酸性和还原性 溶液由无色变为红色 吸收多余的氯气和二氧化硫 使两种气体充分混合;通过观察气泡的速度控制气体流量,使二者按一定比列混合 2SO2+Cl2 +2H2O=4H++SO42-+2Cl- SO2和Cl2的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性
【解析】(1)实验室利用二氧化锰与浓盐酸在加热条件下制备氯气,反应生成氯化锰、氯气与水,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑,反应中氯元素化合价升高,同时还有氯化锰生成,则反应中浓盐酸所表现出的性质是酸性和还原性;反应需要加热,所以应该用E制备氯气,用A制备二氧化硫;(2)B装置中二氧化硫和有色物质化合生成不稳定无色物质,使品红溶液红色褪去,再加热B中褪色后溶液时,又恢复红色,因此B试管中的现象是溶液由无色变为红色;(3)二氧化硫、氯气均有毒,直接排放会污染空气,装置C的作用是吸收多余的SO2和Cl2;(4)①浓硫酸和二氧化硫、氯气不反应,但氯气和二氧化硫在该装置中能充分混合,且通过观察气泡的速度控制气体流量,使二者按一定比列混合,即通过盛有浓硫酸装置的目的是使两种气体充分混合;通过观察气泡的速度控制气体流量,使二者按一定比列混合;②氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应而使气体失去漂白性,离子反应方程式为2SO2+Cl2+2H2O=4H++SO42-+2Cl-;③通气一段时间后,品红溶液颜色随时间推移变得越来越浅,说明有漂白性;这说明SO2和Cl2的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性。
Mn2++2H2O+Cl2↑,反应中氯元素化合价升高,同时还有氯化锰生成,则反应中浓盐酸所表现出的性质是酸性和还原性;反应需要加热,所以应该用E制备氯气,用A制备二氧化硫;(2)B装置中二氧化硫和有色物质化合生成不稳定无色物质,使品红溶液红色褪去,再加热B中褪色后溶液时,又恢复红色,因此B试管中的现象是溶液由无色变为红色;(3)二氧化硫、氯气均有毒,直接排放会污染空气,装置C的作用是吸收多余的SO2和Cl2;(4)①浓硫酸和二氧化硫、氯气不反应,但氯气和二氧化硫在该装置中能充分混合,且通过观察气泡的速度控制气体流量,使二者按一定比列混合,即通过盛有浓硫酸装置的目的是使两种气体充分混合;通过观察气泡的速度控制气体流量,使二者按一定比列混合;②氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应而使气体失去漂白性,离子反应方程式为2SO2+Cl2+2H2O=4H++SO42-+2Cl-;③通气一段时间后,品红溶液颜色随时间推移变得越来越浅,说明有漂白性;这说明SO2和Cl2的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性。