��Ŀ����
����Ŀ��Ԫ��A��B��C��D��E��F��G��Ԫ�����ڱ��е�λ����ͼ1��ʾ���ش��������⣺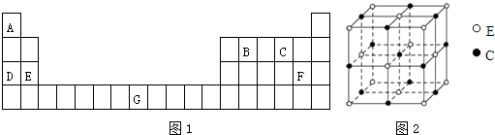
��1��G�Ļ�̬ԭ�Ӻ�������Ų�ʽΪ �� ԭ�ӵĵ�һ�����ܣ�DE���������������
��2�����ݼ۲���ӻ������ۣ��۲���Ӷ�֮��ij�����С������˳��l��l��l��b��b��b��lΪ�¶Ե��Ӷԣ�bΪ���ϵ��Ӷԣ��������A2C�е�A��C��A���ǿɵó��Ľ����� ��
A.180��
B.�ӽ�120�㣬��С��120��
C.�ӽ�120�㣬������120��
D.�ӽ�109��28�䣬��С��109��28��
��3��������G��BC��5���۵�Ϊ��20�棬�е�Ϊ103�棬������������壬�������д��ڵĻ�ѧ�������� �� ���ڿ�����ȼ�����ɺ���ɫ�������Ӧ�Ļ�ѧ����ʽΪ ��
��4��������BCF2�����幹��Ϊ �� ����Bԭ�ӵ��ӻ���������� �� д��������BCF2������ͬ�ռ乹�͵ĺ���������� ��
��5��������EC�ľ����ṹ��ͼ2��ʾ����������a=0.424nm��ÿ�������к�����E2+ �� ��ʽ����EC������ܶ� gcm��3 ��
���𰸡�
��1��1s22s22p63s23p63d64s2����
��2��D
��3�����ӣ���λ�������ۼ���4Fe��CO��3+9O2 ![]() 2Fe2O3+12CO2
2Fe2O3+12CO2
��4��ƽ�������Σ�sp2��NO3����CO32����
��5��4��3.49
���������⣺��Ԫ�������ڱ��е�λ�ã���֪AΪHԪ�ء�BΪ̼Ԫ�ء�CΪOԪ�ء�DΪNaԪ�ء�EΪMg��FΪCl��GΪFe����1��Feԭ�Ӻ��������Ϊ26����Fe�Ļ�̬�����Ų�ʽΪ1s22s22p63s23p63d64s2 �� ������Na��Mg��Mg��3s����Ϊȫ���ȶ��ṹ����ԭ�ӵĵ�һ�����ܣ�D��E��
���Դ��ǣ�1s22s22p63s23p63d64s2��������2��H2O�к�2�Թ¶Ե��ӣ�2�����ϵ��Ӷԣ�ΪV�ͽṹ�����ǽӽ�109��28�䣬��С��109��28�䣬��ѡD����3��������Fe��CO��3���۵�Ϊ��20�棬�е�Ϊ103�棬�۷е�Ƚϵͣ����ڷ��Ӿ��壬����λ�������ۼ������ڿ�����ȼ�����ɺ���ɫ�������������Ϊ�������������ɶ�����̼����Ӧ����ʽΪ��4Fe��CO��3+9O2 ![]() 2Fe2O3+12CO2 ��
2Fe2O3+12CO2 ��
���Դ��ǣ����ӣ���λ�������ۼ���4Fe��CO��3+9O2 ![]() 2Fe2O3+12CO2����4��������COCl2��Cԭ���γ�3���Ҽ���û�й¶Ե��ӣ��۲���Ӷ���Ϊ3��Cԭ��Ϊsp2�ӻ����ռ�ṹΪƽ�������Σ���COCl2������ͬ�ռ乹�͵ĺ���������ӵ�����ԭ������3��Oԭ����û�й¶Ե��ӣ�ΪNO3����CO32���ȣ�
2Fe2O3+12CO2����4��������COCl2��Cԭ���γ�3���Ҽ���û�й¶Ե��ӣ��۲���Ӷ���Ϊ3��Cԭ��Ϊsp2�ӻ����ռ�ṹΪƽ�������Σ���COCl2������ͬ�ռ乹�͵ĺ���������ӵ�����ԭ������3��Oԭ����û�й¶Ե��ӣ�ΪNO3����CO32���ȣ�
���Դ��ǣ�ƽ�������Σ�sp2��NO3����CO32���ȣ���4��������Mgԭ����ĿΪ6�� ![]() +8��
+8�� ![]() =4��Oԭ����Ŀ=1+12��
=4��Oԭ����Ŀ=1+12�� ![]() =4��������Ϊ4��
=4��������Ϊ4�� ![]() g���������������߳���Ϊ0.424nm������٤������ΪNA �� �þ�����ܶ�Ϊ 4��
g���������������߳���Ϊ0.424nm������٤������ΪNA �� �þ�����ܶ�Ϊ 4�� ![]() g�£�0.424��10��7cm��3=3.49 g��cm��3 ��
g�£�0.424��10��7cm��3=3.49 g��cm��3 ��
���Դ��ǣ�4��3.49��

 ͬ��ѧ��һ�ζ���ϵ�д�
ͬ��ѧ��һ�ζ���ϵ�д� �����ܾ�ϵ�д�
�����ܾ�ϵ�д� ���ƿ�����ϵ�д�
���ƿ�����ϵ�д�