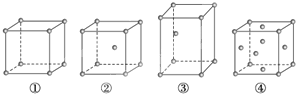
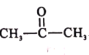
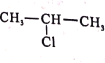
题目内容
【题目】在乏燃料后处理流程中,四价铀作为铀钚分离的还原剂己广泛使用。在UO2(NO3)-2HNO3-N2H4。HNO3体系下采用电解法制备四价铀,电解总反应为2UO22++N2H5++3H+![]() 2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是
2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是
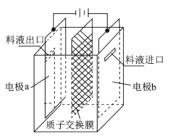
A.若转移4mol e-,将有4mol H+透过质子交换膜
B.b极的电极反应式为UO22++2H2O+2e-=U4++4OH-
C.电解液中NO3-的移动方向:a→质子交换膜→b
D.当产生11.2 mL N2时,同时生成U4+的质量为0.2389
【答案】A
【解析】
此装置为电解池模型,结合图像可知,a极接电源负极,为电解池阴极,UO22+在阴极得到电子,发生的电极反应为:UO22++2H2O+2e-===U4++4OH-,b接电源正极,为电解池阳极,N2H5在阳极得到电子,发生的电极反应为:N2H5+-4e-=== N2↑+5H+,H+经质子交换膜向阴极(a极)移动,据此可分析选项。
A.根据上述分析,电极a是阴极,电极b是阳极,电解池中阳离子向阴极移动,根据电荷守恒可知,导线中转移4mol e-,溶液中消耗4molH+,H+透过质子交换膜向阴极(a极)移动,A选项正确;
B.酸性环境下,b电极发生的反应为:N2H5+-4e-=== N2↑+5H+,B选项错误;
C.NO3-不能透过质子交换膜,C选项错误;
D.未注明标准状况,不能够准确计算,D选项错误;
答案选A。

练习册系列答案
相关题目