题目内容
【题目】氨、尿素[CO(NH2)2]都是氮的重要化合物,在工农业生产中应用广泛。
(1)已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92kJ·mol-1
2NH3(g)ΔH=-92kJ·mol-1
①取1molN2(g)和3molH2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量____92.2kJ(填“>”、“=”或“<”),原因是_______________。
②使用催化剂,该反应△H_____(填“变大”“变小”或“不变”)。
③已知:分别破坏1molN≡N键、1molH-H键需要吸收的能量为:946kJ、436kJ,则破坏1molN-H键需要吸收的能量为_____。
④当容积一定时,能判断该反应是否达到化学平衡状态的依据是_______________
a.容器中总压强不变 b.混合气体中c(CO)不变 c.v正(H2)=v逆(N2)
d.c(H2)=c(NH3) e. 混合气体密度不再变化 f.颜色不再变化
g. 混合气体平均相对分子质量不再变化
(2)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
Ⅰ.2NH3(g)+CO2(g)==NH2CO2NH4(s)△H=﹣159.5kJ/mol
Ⅱ.NH2CO2NH4(s)==CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
Ⅲ.H2O(l)==H2O(g)△H=+44.0kJ/mol
①写出CO2与NH3合成尿素和液态水的热化学反应方程式_______________________。
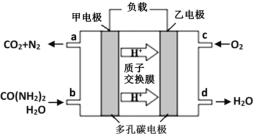
②化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示,回答下列问题:
电池中的负极为_____(填“甲”或“乙”),乙的电极反应式为_____________,电池工作时,理论上每净化1mol尿素,消耗O2的体积(标准状况下)约为_____L。
【答案】< 由于为可逆反应,反应物无法全部转化,1molN2和3molH2充分参与反应也不可能生成2molNH3,故放出的热量小于92kJ 不变 391 kJ a和g 2NH3(g)+CO2(g) == CO(NH2)2(s)+H2O(l) △H=﹣87.0kJ/mol 甲 O2+4e-+4H+=2H2O 33.6
【解析】
(1)①合成氨反应为可逆反应,不可能进行到底,故在实际生产中1molN2和3molH2不可能生成2molNH3,放出的热量也必定小于92kJ;
②催化剂改变反应速率不改变化学平衡及△H;
③△H=反应物的键能之和-生成物的键能之和;
④当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,以此判断;
(2)①根据盖斯定律计算;
②该电池CO(NH2)2在负极失电子生成二氧化碳和氮气,氧气在正极反应生成水,电解质溶液中含氢离子,该反应的总方程式为:2CO(NH2)2+3O2=2CO2+2N2+4H2O,结合2 CO(NH2)2~3O2计算,以此来解答。
(1)①N2(g)+3H2(g)2NH3(g)△H=-92 kJmol-1,N2和H2反应生成2 mol NH3时放出的热量为92.2 kJ,是指1 mol氮气和3 mol的氢气完全反应生成2 mol的氨气放出的热量为92.2 kJ,1mol N2和3 molH2放在密闭容器中不可能完全转化为氨气,所以放出热量一定小于92.2 kJ,故答案为:<;由于该反应是可逆反应,反应物无法全部转化为生成物;
②催化剂改变反应速率不改变化学平衡,反应热不变,故答案为:不变;
③分别破坏1 mol N≡N键、1 mol H-H键需要吸收的能量为:946 kJ、436 kJ,设破坏1 mol N-H键需要吸收的能量为x,根据N2(g)+3H2(g)2NH3(g)△H=-92 kJmol-1,焓变=反应物总键能-生成物的总键能,即946 kJ/mol+3×436 kJ/mol-6x=-92.2 kJ/mol,解得x=391 kJ/mol,即破坏1 mol N-H键需要吸收的能量为391 kJ,故答案为:391;
④a.容器容积一定,平衡正向移动时气体的物质的量减小,压强减小,所以容器中总压强不变可以说明反应达到平衡,故a符合;
b.混合气体无CO,所以混合气体中c(CO)不变不能说明反应达到平衡,故b不符合;
c.当反应达到平衡时v正(H2)=v逆(H2),v逆(H2)=3 v逆(N2),所以v正(H2)=v逆(N2)时不能说明反应达到平衡,故c不符合;
d.平衡正向移动时c(H2)减小,c(NH3)增大,可能有某一时刻c(H2)=c(NH3),但不能说明反应达到平衡,故d不符合;
e. 混合气体总体积不变,总质量不变,所以混合气体密度在平衡移动时不会发生变化,故e不符合;
f. 该反应中生成物和反应物均为无色气体,所以不会有颜色变化,故f不符合;
g. 混合气体的总质量不变,但平衡正向移动时混合气体的总物质的量减小,所以混合气体平均相对分子质量增大,当混合气体平均相对分子质量不再变化时说明反应达到平衡,故g符合;
故答案为:a和g
(2)①由Ⅰ.2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJmol-1
Ⅱ.NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJmol-1
Ⅲ.H2O(l)=H2O(g)△H=+44.0kJmol-1
结合盖斯定律可知,①+②-③得到2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l),其△H=-159.5 kJmol-1+(+116.5kJmol-1)-(+44.0kJmol-1)=-87.0kJmol-1,则CO2与NH3合成尿素和液态水的热化学反应方程式为2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-87.0 kJ/mol,故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-87.0 kJ/mol;
②根据图示可知,甲电极上CO(NH2)2反应生成二氧化碳和氮气,N元素化合价升高,失电子,为电源的负极,电解质溶液为酸性,则乙电极为正极,发生还原反应,氧气得电子之后生成水,则其电极反应式为:O2+4e-+4H+=2H2O,该反应的总方程式为2CO(NH2)2+3O2=2CO2+2N2+4H2O,根据关系式2 CO(NH2)2~3O2可知,电池工作时,理论上每净化1mol尿素,消耗O2的体积为1.5 mol×22.4 L/mol=33.6 L,故答案为:甲;O2+4e-

【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH=+131.3 kJmol-1。
CO(g)+H2(g) ΔH=+131.3 kJmol-1。
①该反应在常温下____________自发进行(填“能”与“不能”);
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是______________(填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.c(CO)=c(H2) d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2) 表示的反应速率为________________ 。(取小数二位,下同)
②该反应为 _____(填“吸”或“放”)热反应,实验2条件下平衡常数K=________。
③若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是________________________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJmol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJmol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是___________。

a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2