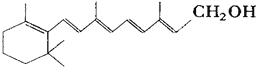
题目内容
【题目】下列离子反应方程式书写正确的是 ( )
A.在Ba(OH)2溶液中加入少量的硫酸氢钠溶液Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
B.向次氯酸钙溶液中通入SO2气体Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.标准状况下,将112mLCl2缓慢通入10mL 1mol·L-1的FeBr2溶液中2Fe2++4Br-+3Cl2 =2Fe3++6Cl-+2Br2
D.向苯酚钠溶液中通入少量CO2气体![]() +CO2+H2O
+CO2+H2O![]()
![]() +HCO
+HCO![]()
【答案】D
【解析】
A.在Ba(OH)2溶液中加入少量的硫酸氢钠溶液的离子反应为Ba2++OH-+H++SO42-=BaSO4↓+H2O,故A错误;
B.向次氯酸钙溶液中通入SO2气体的离子反应为Ca2++ClO-+SO2+H2O=CaSO4↓+2H++Cl-,故B错误;
C.n(Cl2)=![]() =0.005mol,n(FeBr2)=0.01L×1mol/L=0.01mol,还原性亚铁离子大于溴离子,由电子守恒可知,离子反应为2Fe2++Cl2=2Fe3++2Cl-,故C错误;
=0.005mol,n(FeBr2)=0.01L×1mol/L=0.01mol,还原性亚铁离子大于溴离子,由电子守恒可知,离子反应为2Fe2++Cl2=2Fe3++2Cl-,故C错误;
D.向苯酚钠溶液中通入少量CO2气体的离子反应为![]() +HCO3-,故D正确;
+HCO3-,故D正确;
故选:D。

【题目】以下是一些物质的熔沸点数据(常压):
钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(完全分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
(1)上述反应的平衡常数表达式为________________;若4v正(Na)=3v逆(CO2),反应是否达到平衡________ (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为________________。
(3)高压下有利于金刚石的制备,理由_____________________________________________。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H= —357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式:___________________________