题目内容
【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH=+131.3 kJmol-1。
CO(g)+H2(g) ΔH=+131.3 kJmol-1。
①该反应在常温下____________自发进行(填“能”与“不能”);
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是______________(填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.c(CO)=c(H2) d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2) 表示的反应速率为________________ 。(取小数二位,下同)
②该反应为 _____(填“吸”或“放”)热反应,实验2条件下平衡常数K=________。
③若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是________________________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJmol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJmol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是___________。

a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
【答案】不能 b d 0.13mol(Lmin)-1 放 K=0.17 b=2a,a>1 c、d
【解析】
(1)①对于反应C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH=+131.3 kJmol-1,ΔH>0,ΔS>0,根据ΔG=ΔH-TΔS<0反应能自发进行,可知在高温条件下反应能自发进行,常温下不能自发进行;答案为:不能;
CO(g)+H2(g) ΔH=+131.3 kJmol-1,ΔH>0,ΔS>0,根据ΔG=ΔH-TΔS<0反应能自发进行,可知在高温条件下反应能自发进行,常温下不能自发进行;答案为:不能;
②一定温度下,在一个容积可变的密闭容器中发生上述反应,根据“正逆相等,变量不变”可判断一个可逆反应是否达到化学平衡状态;
a.因为容器的容积可变,说明是恒压条件,故容器中的压强不变不能说明反应达到平衡,a错误;
b.1 mol H—H键断裂表示逆反应, 2 mol H—O键断裂表示正反应,且正逆反应速率相等,说明反应达到平衡,b正确;
c.c(CO)=c(H2)并不能说明正逆反应速率相等或各组分的百分含量不变,不能说明反应达到平衡,c错误;
d.因为该反应是一个气体物质的量增加的反应,由于容器的容积可变,随反应进行,容器的容积增大,故当容器的容积不变时说明反应达到平衡,d正确;
故选bd;
(2)①根据CO(g)+H2O(g) ![]() CO2(g)+H2(g),结合表中数据,平衡时消耗的CO的物质的量为1.6mol,则生成的CO2的物质的量为1.6mol,CO2的浓度变化为0.8 mol/L,根据
CO2(g)+H2(g),结合表中数据,平衡时消耗的CO的物质的量为1.6mol,则生成的CO2的物质的量为1.6mol,CO2的浓度变化为0.8 mol/L,根据![]() 可得
可得![]() (CO2)=
(CO2)=![]() ;
;
②根据表中1、2两组实验数据,假设温度相同,实验2相对于实验1为减小压强,因为该反应反应前后气体物质的量不变,则两平衡等效,平衡时H2的物质的量应该为0.8mol,但由于温度升高,H2的物质的量为0.4mol,说明升温平衡逆向移动,则该反应为放热反应;容器的容积为2L,结合表中实验2的数据,利用三段式:
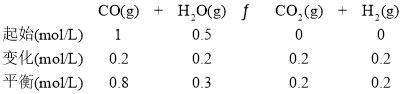
则![]() =
=![]() ;
;
③实验3与实验2反应温度相同,若平衡状态中各物质的质量分数分别相等,则为等效平衡,则a、b应满足的关系是a:b=1:2,即b=2a,若t<3min,说明实验3容器内压强大于实验2,则a>1(或b>2);
答案为:①放 ②0.17 ③b=2a,a>1;
(3)根据图象可知CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)为放热反应,在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,
CH3OH(g)+H2O(g)为放热反应,在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,
a.升高温度,平衡逆向移动,c(CH3OH)减小,a错误;
b.充入He(g),使体系压强增大,平衡不移动,c(CH3OH)不变,b错误;
c.将H2O(g)从体系中分离出来,平衡逆向移动,c(CH3OH)增大,c正确;
d.再充入1mol CO2和3mol H2,等效成增大压强,平衡正向移动,c(CH3OH)增大,d正确;
故选cd。