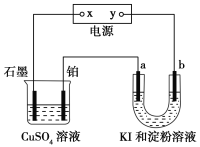
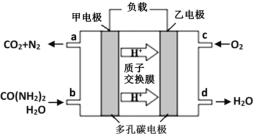
��Ŀ����
����Ŀ���о�ȼ�ϵ�ȼ�պͶ���Ⱦ���������������������ڷ�ֹ������Ⱦ����Ҫ���塣
��1����úת��Ϊ�������ȼ�ϣ���֪��H2(g)+1/2O2(g)=H2O(g)![]() H= 241��8kJ/mol��C(s)+1/2O2(g)=CO(g)
H= 241��8kJ/mol��C(s)+1/2O2(g)=CO(g)![]() H= 110��5kJ/mol��д����̿��ˮ������Ӧ��H2��CO���Ȼ�ѧ����ʽ________________________��
H= 110��5kJ/mol��д����̿��ˮ������Ӧ��H2��CO���Ȼ�ѧ����ʽ________________________��
��2��һ�������£����ܱ������ڣ�SO2��������SO3���Ȼ�ѧ����ʽΪ��2SO2(g)+O2(g)![]() 2SO3(g)����H=a kJ/mo1������ͬ������Ҫ��õ�2akJ��������������ʵ����ʵ���������____________
2SO3(g)����H=a kJ/mo1������ͬ������Ҫ��õ�2akJ��������������ʵ����ʵ���������____________
A��4mo1 SO2��2mol O2���������� B��4mol SO2��2mo1 O2��2mol SO3
C��4mol SO2��4mo1 O2������ D��6mo1 SO2��4mo1 O2
��3������β����NOx��CO�����ɼ�ת����
����֪����������NO�ķ�ӦΪ��N2(g)+O2(g)![]() 2NO(g)
2NO(g)![]() H��0����һ���¶��µĶ����ܱ������У���˵���˷�Ӧ�Ѵ�ƽ�����__________
H��0����һ���¶��µĶ����ܱ������У���˵���˷�Ӧ�Ѵ�ƽ�����__________
A��ѹǿ���� B���������ƽ����Է�����������
C��2v��(N2)��v��(NO) D�� N2������������ٸı�
������ȼ�Ͳ���ȫȼ��ʱ����CO���������밴���з�Ӧ��ȥCO��2CO(g)=2C(s)+O2(g)![]() H��0�������������ܷ�ʵ�ֵ�����_______________________________________________��
H��0�������������ܷ�ʵ�ֵ�����_______________________________________________��
��4��ȼ��CO��H2��һ�������¿����ת����CO(g)��H2O(g)![]() CO2(g)��H2(g)����420��ʱ��ƽ�ⳣ��K=9������Ӧ��ʼʱ��CO��H2O��Ũ�Ⱦ�Ϊ0��1mol/L����CO�ڴ˷�Ӧ�����µ�ת����Ϊ______________��
CO2(g)��H2(g)����420��ʱ��ƽ�ⳣ��K=9������Ӧ��ʼʱ��CO��H2O��Ũ�Ⱦ�Ϊ0��1mol/L����CO�ڴ˷�Ӧ�����µ�ת����Ϊ______________��
���𰸡�C(s)+H2O(g)=CO(g)+H2(g)![]() H=+131.3kJ/mol D CD �÷�Ӧ���������ؼ��ķ�Ӧ ����
H=+131.3kJ/mol D CD �÷�Ӧ���������ؼ��ķ�Ӧ ����![]() G=
G=![]() H��T
H��T![]() S,
S,![]() G��0,����ʵ�� 75%
G��0,����ʵ�� 75%
��������
��1�����ݸ�˹���ɽ��з�����
��2�����ݿ��淴Ӧ�ص���з�����
��3���ٸ��ݿ��淴Ӧ�ﵽƽ������淴Ӧ������ȣ�����ֵ�Ũ�ȼ��ɴ����������������������з�����
�ڸ��ݷ�Ӧ���ص�ȷ��![]() H��S�ı仯���������
H��S�ı仯���������![]() G=
G=![]() H��T
H��T![]() S�ж���Ӧ�ܹ�������
S�ж���Ӧ�ܹ�������
��4����������ʽ�����ƽ��ʱ�����ʵ�Ũ�ȣ�Ȼ�����K= ![]() ��ʽ��������ֵ���м��㡣
��ʽ��������ֵ���м��㡣
��1����֪��H2(g)+![]() O2(g)=H2O(g)
O2(g)=H2O(g)![]() H1= 241.8kJ/mol ��C(s)+
H1= 241.8kJ/mol ��C(s)+ ![]() O2(g)=CO(g)
O2(g)=CO(g)![]() H2= 110.5kJ/mol���ݸ�˹���ɣ��÷���ʽ2��ȥ����ʽ1���ɵã�д����̿��ˮ������Ӧ��H2��CO���Ȼ�ѧ����ʽ��1��C(s)+H2O(g)=CO(g)+H2(g)
H2= 110.5kJ/mol���ݸ�˹���ɣ��÷���ʽ2��ȥ����ʽ1���ɵã�д����̿��ˮ������Ӧ��H2��CO���Ȼ�ѧ����ʽ��1��C(s)+H2O(g)=CO(g)+H2(g)![]() H=+131.3kJ/mol��
H=+131.3kJ/mol��
��2���ɷ�Ӧ����ʽ��֪����2mol��SO3ʱ����a kJ����õ�2a kJ��������������4molSO3�����ڷ�Ӧ�ǿ��淴Ӧ����������ȫ���е��ף�����Ҫ�õ�4molSO3��SO2��O2���ʵ�������Ҫ����4mol�� 2mol����D���ϣ�Bѡ���м�������Ӧ�����淴Ӧ�����շų�������С��2akJ����ѡD��
��3����A�����ڷ�Ӧǰ��������䣬��ѹǿʼ�ղ��䲻����Ϊƽ���ж����ݣ�A����
B�����ڷ�Ӧǰ���������������ʵ��������ı䣬�ʻ������ƽ����Է����������䣬�ʲ�����Ϊƽ���ж����ݣ�B����
C. 2v��(N2)��v��(NO)= v��(NO)���������淴Ӧ������ȣ�������֮�Ⱥ�ϵ�������ȹ��ɣ������ж���Ӧ�ﵽƽ��״̬����C��ȷ��
D. N2������������ٸı䣬���淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����D��ȷ��
�ʴ�ѡCD��
���ɷ�Ӧ2CO(g)=2C(s)+O2(g)![]() H��0����֪�÷�Ӧ���������ؼ��ķ�Ӧ������
H��0����֪�÷�Ӧ���������ؼ��ķ�Ӧ������![]() G=
G=![]() H��T
H��T![]() S��
S��![]() G��0������ʵ�֣�
G��0������ʵ�֣�
��4����ƽ��ʱCO��Ũ�ȱ仯��Ϊxmol/L����
CO��g��+H2O��g��CO2��g��+H2��g��
��ʼ��mol/L����0.1 0.1 0 0
�仯��mol/L���� c c c c
ƽ�⣨mol/L���� 0.1-c 0. 1-c c c
��![]() =9 ���c=0��075����һ����̼�ڴ������µ�ƽ��ת����=75%��
=9 ���c=0��075����һ����̼�ڴ������µ�ƽ��ת����=75%��
�ʴ�Ϊ75%��

 ��У����ϵ�д�
��У����ϵ�д�