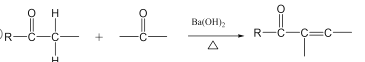题目内容
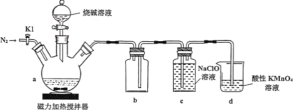
【题目】粮食仓储常用磷化铝(A1P)熏蒸杀虫,A1P遇水即产生强还原性的PH3气体。国家标准规定粮食中磷化物(以PH3计)的残留量不超过0.05 mgkg-1时为合格。某小组同学用图所示实验装置和原理测定某粮食样品中磷化物的残留量。C中加入100 g原粮,E 中加入20.00mL2.50×l0-4molL-1KMnO4溶液(H2SO4酸化),C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中的溶液。
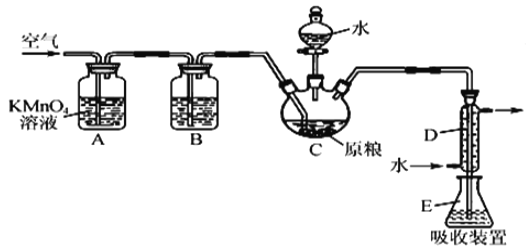
(1)装置A中的KMnO4溶液的作用是_____。
(2)装置B中盛装焦性没食子酸的碱性溶液吸收空气中的O2。若去掉该装置,则测得的磷化物的残留量______________________(填“偏髙”“偏低”或“不变”)。
(3)装置E中PH3氧化成磷酸,MnO4-被还原为Mn2+,写出该反应的离子方程式:___________
(4)收集装置E中的吸收液,加水稀释至250 mL,量取其中的25.00 mL于锥形瓶中, 用4.0×l0-5molL-1的Na2SO3标准溶液滴定,消耗Na2SO3标准溶液20.00mL,反应原理是 SO32-+MnO4-+H+→SO42-+Mn2++H20(未配平)通过计算判断该样品是否合格(写出计算过程)___________。
【答案】吸收空气中的还原性气体,防止其干扰PH3的测定 偏低 5PH3+8MnO4-+24H+=5H3PO4+8Mn2++12H2O 不合格(过程见解析)
【解析】
(1)利用PH3的还原性,测定PH3的含量;
(2)空气中的O2能氧化PH3;
(3)根据得失电子守恒配平氧化还原反应的离子方程式。
(4)PH3、Na2SO3共同消耗KMnO4溶液。
(1) 利用PH3的还原性,测定PH3的含量,所以装置A中的KMn04溶液的作用是吸收空气中的还原性气体,防止其干扰PH3的测定。
(2)空气中的O2能氧化PH3,若不用焦性没食子酸的碱性溶液吸收空气中的O2,则消耗KMnO4溶液的体积偏小,测得的磷化物的残留量偏低;
(3)装置E中PH3氧化成磷酸,MnO4-被还原为Mn2+,根据得失电子守恒,该反应的离子方程式是5PH3+8MnO4-+24H+=5H3PO4+8Mn2++12H2O;
(4) 25mL溶液中未反应的n(KMnO4)=![]() ;
;
250mL溶液中未反应的n(KMnO4) ![]() ;
;
与PH3反应的n(KMnO4)=![]() ;
;
n(PH3 )=![]() n(KMnO4)=
n(KMnO4)= ![]()
![]() =
= ![]() ;
;
100g原粮中n(PH3 )= ![]()
![]() 3.825
3.825![]() g;
g;
1Kg原粮中n(PH3 )= 3.825![]() g=0.3825mg>0.05mg,所以不合格。
g=0.3825mg>0.05mg,所以不合格。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】下列实验可以达到目的或得出结论的是( )
选项 | 实验目的或结论 | 实验过程 |
A | 探究浓硫酸的脱水性 | 向表面皿中加入少量胆矾,再加入约3mL浓硫酸,搅拌,观察实验现象 |
B | 相同温度下,Ksp(ZnS)<Ksp(CuS) | 向2mL ZnSO4 和CuSO4的混合溶液中逐滴加入0.01mol/L Na2S溶液,先出现白色沉淀 |
C | 淀粉已经完全水解 | 取少量酸催化后的淀粉水解液于试管中,先加入过量氢氧化钠溶液中和酸,再加少量碘水,溶液未变蓝 |
D |
| 向NaAlO2的试管中滴加碳酸氢钠溶液,产生白色沉淀 |
A.AB.BC.CD.D