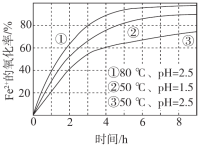
题目内容
【题目】次磷酸钠(NaH2PO2)是有机合成的常用还原剂,一般制备方法是将黄磷(P4)和过量烧碱溶液混合、加热,生成次磷酸钠和PH3,PH3是一种无色、有毒且能自燃的气体。实验装置如图所示:
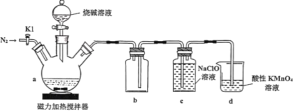
回答下列问题:
(1)在a中加入黄磷、活性炭粉末,打开K1,通入N2一段时间,关闭K1,打开磁力加热搅拌器,滴加烧碱溶液。
①仪器a的名称是______,已知NaH2PO2能与盐酸反应但不能与NaOH溶液反应,则次磷酸(H3PO2)是_______元弱酸。
②反应开始时,首先打开K1,通入N2一段时间,其目的是________。
③为了尽可能避免PH3造成的空气污染,拆卸装置前还要进行的一项操作是_________,a中反应的化学方程式为_______。
(2)装置c中生成NaH2PO2和NaCl,相关物质溶解度(S)如下,通过______的方法可分离出NaH2PO2固体。

(3)产品纯度测定:
取产品m g配成250mL溶液,取25mL于锥形瓶中,然后用0.01 mol/L KMnO4标准溶液滴定至终点(氧化产物是PO43-),达到滴定终点时消耗V1 mL KMnO4标准溶液,产品纯度为________。
【答案】三颈烧瓶 一 排尽装置中的空气,防止反应生成的PH3自燃引起爆炸 打开K1,继续通入一段时间N2 P4+3NaOH+3H2O![]() 3NaH2PO4+PH3↑ 蒸发浓缩、冷却结晶 ( 1.1 V1/m)%
3NaH2PO4+PH3↑ 蒸发浓缩、冷却结晶 ( 1.1 V1/m)%
【解析】
制备次磷酸钠,所用的药品是P4和NaOH溶液,加热条件下二者反应生成次磷酸钠的同时也生成了PH3,所以P4发生了歧化反应;题干中给出了关于PH3性质的信息,明确指出该物质无色,有毒能自燃,所以为了避免制备过程中生成的PH3发生自燃,需要在制备前,利用N2将装置内残余的空气排尽;此外,为了避免PH3造成的空气污染,也需要对装置a的出口气体进行吸收;因此,结合PH3还原性较强的特点,利用c中的NaClO对其进行氧化吸收,而装置d则起到验证是否吸收完全的作用,若未吸收完全,则也可对PH3进行吸收;至于装置b的作用,考虑到a装置出口气体组成中含有大量的易与NaClO反应的PH3,所以起到一定的防倒吸作用,防止c中的NaClO进入a中;制备反应结束后,由于装置内会残留部分PH3,出于安全性和环保性的考虑,需要在拆解装置前,持续通一段时间的N2,以尽可能地排尽装置内残余的PH3,使其在c和d装置中被吸收。
(1)①仪器a的名称为三颈烧瓶;由于次磷酸钠不能与NaOH溶液反应,所以![]() 不能电离出H+,所以次磷酸为一元弱酸;
不能电离出H+,所以次磷酸为一元弱酸;
②由于制备过程中会生成能自燃的PH3,所以需要在制备前通一段时间的N2,排尽装置内的空气,以防止PH3自燃;
③PH3有毒,制备结束后,装置内仍会残余少量的PH3气体,出于安全性和环保性的考虑,需要在拆解装置前,再持续通一段时间的N2,使残余的PH3尽可能地排尽,使其在c和d装置内被吸收;a中发生的是P4的歧化反应,制备出次磷酸钠的同时也产生了PH3,所以方程式为:![]() ;
;
(2)分析题中给出的不同温度下次磷酸钠和氯化钠溶解度的表格可知,次磷酸钠溶解度随温度变化很明显,所以从混合溶液中分离次磷酸钠的方法即:蒸发浓缩,冷却结晶;
(3)在计算产品纯度时,一定要注意题干中在用样品配制成溶液后,只取了一部分进行滴定;次磷酸钠与高锰酸钾反应,由题可知,P最终被氧化成![]() ,所以有:
,所以有:![]() ;所以产品纯度=
;所以产品纯度=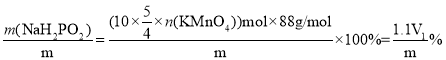 。
。

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)ΔH3=+akJ·mol-1
CO2(g)+4H2(g)ΔH3=+akJ·mol-1
化学键 | C—H | H—H | H—O |
键能kJ/mol | b | c | d |
(1)写出甲烷的结构式___________
(2)C=O的键能为_______________kJ/mol(用含a、b、c、d的式子表示)
(3)恒温条件下,在体积恒为0.5L的密闭容器中通入一定量甲烷和水蒸气,发生上述反应。测得甲烷物质的量随时间变化如下表所示。0~10min内用H2O的浓度表示该反应的平均速率为υ(H2O)=_____________
时间/min | 0 | 10 | 20 | 40 | 50 | 60 |
n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 | 0.10 |
(4)恒温恒容情况下,下列叙述能说明此反应达到平衡状态的是_______________。
a.混合气体的平均相对分子质量保持不变b.CO2和H2的体积分数比为1﹕4
c.混合气体的密度保持不变d.1molCO2生成的同时有4molH-H键断裂
(5)写出甲烷燃料电池,以KOH溶液为介质时,负极的电极反应式______