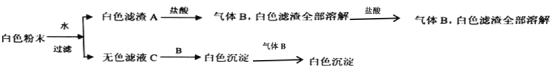
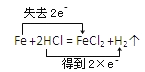
题目内容
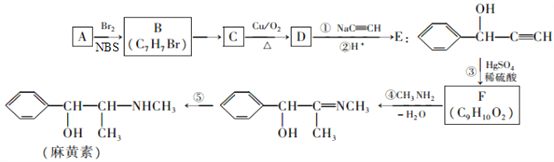
【题目】麻黄素是中枢神经兴奋剂,其合成路线如图所示。NBS是一种选择性溴代试剂。
已知:①A的分子量为92
②
(1)其中A为烃,则A的分子式是__________
(2)写出B![]() C的化学方程式_______
C的化学方程式_______
(3)实验室检验D中官能团的方法为________。
(4)反应①的反应类型是______,F的结构简式是__________。
(5)有机物N与F互为同分异构体,满足下列条件的有机物N的结构有_____种;
①苯环上只有一个取代基 ②能发生水解反应 ③含有甲基
(6)参照上述合成路线信息,设计一条以乙醇为原料选用必要的试剂合成CH3CHOHCOCH3的流程。_____________
【答案】 C7H8  +NaOH
+NaOH![]()
 +NaBr 取物质D的样品少量于试管中,加入银氨溶液,水浴加热后若有光亮的银镜出现说明D中含有醛基。(或加入新制取的氢氧化铜的碱性悬浊液加热后出现红色沉淀) 加成反应
+NaBr 取物质D的样品少量于试管中,加入银氨溶液,水浴加热后若有光亮的银镜出现说明D中含有醛基。(或加入新制取的氢氧化铜的碱性悬浊液加热后出现红色沉淀) 加成反应 ![]() 5 CH3CH2OH
5 CH3CH2OH![]() CH3CHO
CH3CHO![]()
![]()
![]()
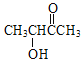
【解析】试题分析:本题考查有机推断和有机合成,侧重考查有机物分子式的确定、官能团的识别、有机物结构简式和方程式的书写、官能团的检验、限定条件同分异构体数目的确定、有机合成路线的设计。
(1)A为烃,A的相对分子质量为92,用“商余法”,92![]() 12=7……8,A的分子为C7H8。
12=7……8,A的分子为C7H8。
(2)根据流程对比A和B的分子式,A→B为取代反应;C与Cu/O2、加热转化为D,C→D为醇的催化氧化,C中含醇羟基,D中含醛基;D与①NaC![]() CH、②H+作用后得到E,根据E的结构简式可逆推出D的结构简式为
CH、②H+作用后得到E,根据E的结构简式可逆推出D的结构简式为![]() ,C的结构简式为
,C的结构简式为 ,B的结构简式为
,B的结构简式为 ,A的结构简式为
,A的结构简式为![]() 。B→C的化学方程式为
。B→C的化学方程式为 +NaOH
+NaOH![]()
 +NaBr。
+NaBr。
(3)D的结构简式为![]() ,D中的官能团为-CHO,检验-CHO可用银氨溶液或新制Cu(OH)2悬浊液,检验D中官能团的方法:取物质D的样品少量于试管中,加入银氨溶液,水浴加热后若有光亮的银镜出现说明D中含有醛基。(或加入新制取的Cu(OH)2的碱性悬浊液加热后若出现红色沉淀说明D中含有醛基)
,D中的官能团为-CHO,检验-CHO可用银氨溶液或新制Cu(OH)2悬浊液,检验D中官能团的方法:取物质D的样品少量于试管中,加入银氨溶液,水浴加热后若有光亮的银镜出现说明D中含有醛基。(或加入新制取的Cu(OH)2的碱性悬浊液加热后若出现红色沉淀说明D中含有醛基)
(4)根据D和E的结构简式,以及D→E的反应试剂,反应①的反应类型为加成反应。根据E→F的反应条件,E→F发生题给已知②的反应,结合F的分子式(C9H10O2),F的结构简式为![]() 。
。
(5)F的不饱和度为5,F的同分异构体N能发生水解反应,N中含酯基,N的苯环上只有一个取代基且含有甲基;符合条件的N的结构简式为:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,符合条件的N的结构有5种。
,符合条件的N的结构有5种。
(6)CH3CHOHCOCH3与F中含有相同的官能团,对比CH3CH2OH和CH3CHOHCOCH3的结构简式,本题的合成路线应仿流程中C→D→E→F,CH3CH2OH先发生催化氧化反应生成CH3CHO,CH3CHO与①NaC![]() CH、②H+作用得到
CH、②H+作用得到![]() ,
,![]() 在HgSO4、稀硫酸存在下生成CH3CHOHCOCH3,合成路线为:CH3CH2OH
在HgSO4、稀硫酸存在下生成CH3CHOHCOCH3,合成路线为:CH3CH2OH![]() CH3CHO
CH3CHO![]()
![]()
![]()
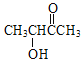 。
。

 小学能力测试卷系列答案
小学能力测试卷系列答案