题目内容
13.某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验.制备硫酸亚铁晶体主要的操作流程如图1.请根据题目要求回答下列问题.(1)A的化学式为Fe,上述操作过程中用到的玻璃仪器有:①烧杯;②普通漏斗;③酒精灯;④温度计;⑤漏斗.
(2)趁热过滤的目的是防止硫酸亚铁晶体析出.
(3)结晶操作过程中应控制使滤液呈酸性的原因是抑制Fe2+离子水解.
(4)已知硫酸亚铁铵[(NH4)2Fe(SO4)2]比硫酸亚铁稳定,硫酸亚铁铵可用硫酸铵和硫酸亚铁反应制得.实验室利用硫酸亚铁铵溶液和草酸溶液反应生成草酸亚铁沉淀来制备草酸亚铁.写出硫酸亚铁铵溶液与草酸溶液反应的离子方程式Fe2++H2C2O4=FeC2O4↓+2H+.
(5)草酸亚铁晶体受热易分解.某课外小组取18.0g草酸亚铁晶体,设计如图的实验装置来检验其分解产物,确定化学式.
①该装置中最不合理的部分A(填字母),原因是反应生成的水易沿试管壁流下使试管炸裂.
②改用正确装置实验开始,B处变蓝,说明草酸亚铁晶体中有结晶水;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生CO、CO2(填化学式);当加热至质量不再变化时,A中残留黑色固体7.2克,则草酸亚铁晶体的化学式为FeC2O4•2H2O.

分析 (1)加入过量的铁粉,与Fe3+、Cu2+、H+离子反应转化为Fe2+;过滤使用的主要玻璃仪器是普通漏斗;
(2)趁热过滤的目的是:要避免某些成分在过滤过程中因遇冷而结晶或沉淀;
(3)应从盐类水解的角度考虑,防止硫酸亚铁水解造成损耗;
(4)由题意可知(NH4)2Fe(SO4)2与草酸反应的方程式:(NH4)2Fe(SO4)2+H2C2O4=FeC2O4↓+(NH4)2SO4+H2SO4;
(5)草酸亚铁晶体加热时有可能有水产生,故A装置最不合理,因为大试管管口略向上倾斜,产生的水会回流使试管炸裂,根据B、C、E判断产物有H2O(或结晶水)、CO2、CO,其中CO的存在使高价铁不可能存在,考虑残留黑色固体,应为FeO,设草酸亚铁晶体的化学式为FeC2O4•xH2O,根据FeC2O4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO+CO2+xH2O,结合晶体和氧化亚铁的质量可计算出x的值,确定化学式.
解答 解:(1)加入过量的铁粉,与Fe3+、Cu2+、H+离子反应转化为Fe2+;过滤使用的主要玻璃仪器有:烧杯、玻璃棒、普通漏斗,
故答案为:Fe;漏斗;
(2)趁热过滤的目的是:要避免某些成分在过滤过程中因遇冷而结晶或沉淀,
故答案为:防止硫酸亚铁晶体析出;
(3)亚铁离子可以水解,结晶操作过程中控制滤液的酸性,可以抑制硫酸亚铁水解造成损耗,
故法案为:抑制Fe2+离子水解;
(4)由题意可知(NH4)2Fe(SO4)2与草酸反应的方程式:(NH4)2Fe(SO4)2+H2C2O4=FeC2O4↓+(NH4)2SO4+H2SO4,故反应离子方程式为:Fe2++H2C2O4=FeC2O4↓+2H+,
故答案为:Fe2++H2C2O4=FeC2O4↓+2H+;
(5)①加热固体时可能有水产生,故A装置最不合理,因为大试管管口略向上倾斜,产生的水会回流使试管炸裂,
故答案为:A;反应生成的水易沿试管壁流下使试管炸裂;
②改用正确装置,实验开始后,B处变蓝色,说明草酸亚铁晶体中有结晶水;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生:CO、CO2;CO的存在使高价铁不可能存在,考虑残留黑色固体,应为FeO,
设草酸亚铁晶体的化学式为FeC2O4•xH2O,
根据FeC2O4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO+CO2+xH2O
144+18x 72
18 7.2
$\frac{144+18x}{18}$=$\frac{72}{7.2}$ x=2,
所以草酸亚铁晶体的化学式为FeC2O4•2H2O,
故答案为:结晶水;CO、CO2;FeC2O4•2H2O.
点评 本题以硫酸亚铁晶体的制备为载体,主要考查了除杂提纯的基本操作、对实验步骤原理和目的分析评价、对装置的分析评价等,明确原理是解题关键,弄清所发生的化学反应及铁元素存在形态的变化.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案| A. | 盐酸溶液 | B. | 硫酸溶液 | C. | 氢氧化钠溶液 | D. | 硫酸钾溶液 |
| A. | 原混合气体的体积为1.2V L | B. | 原混合气体的体积为1.1V L | ||
| C. | 反应达平衡时气体A消耗掉0.05V L | D. | 反应达平衡时气体B消耗掉0.05V L |
| A. | CH4+C12$\stackrel{光}{→}$CH3Cl+HCl | B. | CH2=CH2+C12→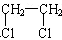 | ||
| C. | 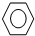 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$ +HBr +HBr | D. | CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O |