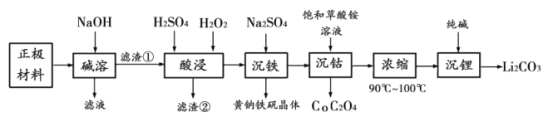
题目内容
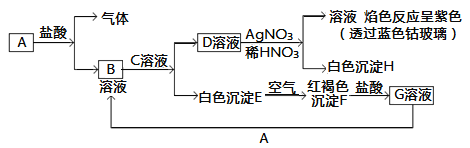
【题目】下列编号代表元素周期表中的一部分元素,用化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | ⑦ | ⑧ | |||||
三 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
四 | ② | ④ |
(1)①、③、⑤的最高价氧化物的水化物碱性由强到弱顺序为___________(填化学式,下同)。
(2)②、③、④形成的简单阳离子半径由大到小的顺序是______________。
(3)⑨和⑩的最高价氧化物对应的水化物化学式为_______和_________。①在氧气中点燃生成淡黄色的固体,该固体的电子式为_______________,①能够与水剧烈反应,请写出该反应的化学方程式_______________,将元素⑩的单质通入NaBr溶液中,反应的离子方程式为_______________。
(4)⑥、⑦、⑧三种元素形成的气态氢化物的稳定性排序是____________(填化学式,下同),三种元素非金属性由强到弱的顺序为___________。
【答案】NaOH>Mg(OH)2>Al(OH)3 K+>Ca2+>Mg2+ H2SO4 HClO4 ![]() 2Na+2H2O=2NaOH+H2↑ Cl2+2Br- =Br2+2Cl- HF>H2O>NH3 F>O>N
2Na+2H2O=2NaOH+H2↑ Cl2+2Br- =Br2+2Cl- HF>H2O>NH3 F>O>N
【解析】
根据元素在周期表中的位置知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为N、⑦为O、⑧为F、⑨为S、⑩为Cl,结合元素周期律和元素化合物的性质分析解答。
(1) 同一周期元素中,元素的金属性随着原子序数的增大而减弱,元素的金属性越强,其最高价氧化物的水化物的碱性越强,Na的金属性最强,Al的金属性最弱,则碱性由强到弱顺序为NaOH>Mg(OH)2>Al(OH)3,故答案为: NaOH>Mg(OH)2>Al(OH)3;
(2) 一般而言,电子层越多,半径越大,电子层数相同,核电荷数越大,半径越小,②、③、④形成的简单阳离子半径由大到小的顺序是K+>Ca2+>Mg2+,故答案为:K+>Ca2+>Mg2+;
(3)⑨和⑩的最高价氧化物对应的水化物化学式分别为H2SO4和HClO4;①在氧气中点燃生成的淡黄色固体为过氧化钠,过氧化钠是离子化合物,电子式为![]() ,钠能够与水剧烈反应产生氢气,反应的化学方程式为2Na+2H2O=2NaOH+H2↑;将氯气通入NaBr溶液中置换出溴,反应的离子方程式为Cl2+2Br-=Br2+2Cl-,故答案为:H2SO4;HClO4;
,钠能够与水剧烈反应产生氢气,反应的化学方程式为2Na+2H2O=2NaOH+H2↑;将氯气通入NaBr溶液中置换出溴,反应的离子方程式为Cl2+2Br-=Br2+2Cl-,故答案为:H2SO4;HClO4;![]() ;2Na+2H2O=2NaOH+H2↑;Cl2+2Br- =Br2+2Cl-;
;2Na+2H2O=2NaOH+H2↑;Cl2+2Br- =Br2+2Cl-;
(4)同一周期,从左向右,非金属性增强,气态氢化物的稳定性增强,⑥、⑦、⑧三种元素形成的气态氢化物的稳定性排序是HF>H2O>NH3,三种元素非金属性由强到弱的顺序为F>O>N,故答案为:HF>H2O>NH3;F>O>N。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】下图分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:
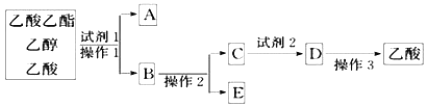
(1)试剂1最好选用_______;
(2)操作1是_______;
(3)试剂2最好选用_______;
(4)操作2是_______;
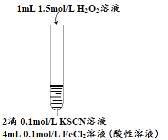
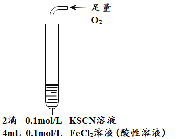
【题目】某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编号 | 实验I | 实验II | 实验III |
实验步骤 |
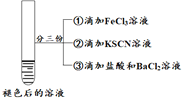
| 将实验I褪色后的溶液分三份分别进行实验
| 为进一步探究“红色褪去”的原因,又进行以下实验 ① ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关