题目内容
15.25℃时,有pH均为5的硫酸、硫酸铵溶液.(1)2种溶液中c(H+)•c(OH-)=10-14.
(2)用离子方程式表示硫酸铵溶液pH=5的原因:NH4++H2O?NH3•H2O+H+.
(3)各取5mL上述溶液,分别加水稀释至50mL,pH较大的溶液是硫酸.
(4)各取5mL上述溶液,分别加热到40℃,pH较小的是硫酸铵溶液.
分析 (1)室温下水的离子积为1×10-14;
(2)硫酸铵是强酸弱碱盐,铵根离子水解而导致其溶液呈酸性;
(3)强酸溶液稀释,氢离子浓度随体积变化减小,氯化铵溶液稀释除随体积变化浓度减小外,稀释促进铵根离子的水解,氢离子浓度增大;
(4)硫酸铵溶液水解过程是吸热反应,加热溶液,促进水解氢离子浓度变大,硫酸溶液加热,氢离子浓度基本不变;
解答 解:(1)室温的条件下,pH均为5的H2SO4溶液和硫酸铵溶液中存在离子积常数,硫酸溶液中,c(H+)酸×c(OH-)水=10-14,硫酸铵溶液中,c(H+)水×c(OH-)水剩余=10-14,室温下两溶液中水的离子积都为Kw=c(H+)•c(OH-)=1×10-14,
故答案为:1×10-14;
(2)硫酸铵是强酸弱碱盐,铵根离子水解NH4++H2O?NH3•H2O+H+生成一水合氨和氢离子,溶液显示酸性,
故答案为:NH4++H2O?NH3•H2O+H+;
(3)室温的条件下,pH均为5的H2SO4溶液和硫酸铵溶液,各取5mL上述溶液,分别加水稀释至50mL,稀释10倍,硫酸溶液PH变化为6,硫酸铵溶液铵根离子水解促进,溶液中氢离子浓度减小的少,溶液PH小于6;pH较大的是硫酸溶液;
故答案为:硫酸;
(4)室温的条件下,pH均为5的H2SO4溶液和硫酸铵溶液,各取5mL上述溶液,分别加热到40℃,硫酸溶液中氢离子浓度变化不大,硫酸铵溶液中水解是吸热反应,加热促进水解,氢离子浓度增大,溶液pH较小的是硫酸铵溶液,
故答案为:硫酸铵溶液.
点评 本题考查了盐类水解的应用判断、溶液pH的定性判断等知识,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握盐的水解原理及其影响因素.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
5.用NA代表阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 钠在氧气中燃烧,1 mol O2作氧化剂时得到的电子数为4NA | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 标准状况下,22.4LCCl4所含有的原子数目为5NA | |
| D. | 1mol Na2O2与足量H2O反应,转移的电子数为NA |
6.铅蓄电池的电极材料是Pb和PbO2,电解液是硫酸溶液.现用铅蓄电池电解饱和硫酸钠溶液一段时间.已知蓄电池放电时发生的反应为PbO2+Pb+2H2SO4═2PbSO4+2H2O,假设电解时温度不变且用惰性电极,下列说法不正确的是( )
| A. | 电解后,c(Na2SO4)不变,且溶液中有晶体析出 | |
| B. | 电解池的阳极反应式为:4OH--4e-═2H2O+O2↑ | |
| C. | 蓄电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 | |
| D. | 蓄电池中每生成2molH2O,电解池中就消耗1molH2O |
3.下列应用中没有涉及原电池反应的是( )
| A. | 锌跟稀硫酸反应制取氢气时,加入少量氧化铜以加快反应速率 | |
| B. | 电解水时加入少量稀硫酸可以加快反应速率 | |
| C. | 电解水一段时间后,将电源换成电流计,指针偏转 | |
| D. | 地下钢铁管道连接镁块,以减少钢铁腐蚀 |
10.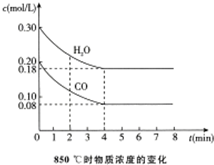 在容积为10L的容器中,850℃和t1℃(高于850℃)时分别发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0
在容积为10L的容器中,850℃和t1℃(高于850℃)时分别发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0
(1)850℃时,通入一定量的CO和H2O,CO和H2O浓度变化如图.
①0~4min的平均反应速率v(CO)=0.03mol/(L•min).
②850℃时,该反应的平衡常数K=1.
t1℃时物质浓度(mol/L)的变化
(2)t1℃时,在相同容器中发生上述反应,容器内各物质的浓度数据如上表.
①上述两个温度下进行的反应,先达到化学平衡状态的温度是t1℃.
②c1>(填“>”“<”或“=”)0.08mol/L.
③反应在4min~5min之间时,若平衡逆向移动,可能的原因是d,表中5min~6min之间数值发生变化,可能的原因是a.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
 在容积为10L的容器中,850℃和t1℃(高于850℃)时分别发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0
在容积为10L的容器中,850℃和t1℃(高于850℃)时分别发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0(1)850℃时,通入一定量的CO和H2O,CO和H2O浓度变化如图.
①0~4min的平均反应速率v(CO)=0.03mol/(L•min).
②850℃时,该反应的平衡常数K=1.
t1℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①上述两个温度下进行的反应,先达到化学平衡状态的温度是t1℃.
②c1>(填“>”“<”或“=”)0.08mol/L.
③反应在4min~5min之间时,若平衡逆向移动,可能的原因是d,表中5min~6min之间数值发生变化,可能的原因是a.
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
20.下列每组物质发生状态变化时,需克服相同类型作用力的是( )
| A. | 食盐和蔗糖熔化 | B. | 碘和干冰升华 | ||
| C. | 金刚石和硫熔化 | D. | 二氧化硅和氧化钠熔化 |
4.下列各反应中,属于原电池反应的是( )
| A. | 氧化铝膜别破坏后,金属铝被迅速氧化 | |
| B. | 白铁镀锌层破坏后,还能阻止铁被氧化 | |
| C. | 红热的铁与水接触表面上形成蓝黑色的保护层 | |
| D. | 铁与稀硫酸反应时,加入少量CuSO4溶液可使反应加快 |
1.下列关于图中钠及其化合物转化的叙述中,不正确的是( )
| A. | ①为离子反应 | B. | ②为置换反应 | C. | ③是化合反应 | D. | ④可能为离子反应 |