题目内容
3.下列应用中没有涉及原电池反应的是( )| A. | 锌跟稀硫酸反应制取氢气时,加入少量氧化铜以加快反应速率 | |
| B. | 电解水时加入少量稀硫酸可以加快反应速率 | |
| C. | 电解水一段时间后,将电源换成电流计,指针偏转 | |
| D. | 地下钢铁管道连接镁块,以减少钢铁腐蚀 |
分析 根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,据此分析.
解答 解:A、锌跟稀硫酸反应制取氢气时,加入少量氧化铜,氧化铜与硫酸反应生成铜离子,锌将铜离子置换成铜单质,与锌形成原电池,故A错误;
B、电解水时加入少量稀硫酸为增强导电性,为电解池,没有涉及原电池反应,故B正确;
C、电解水一段时间后阳极生成氧气,阴极生成氢气,将电源换成电流计,相对于氢氧燃料电池,指针偏转,形成原电池,故C错误;
D、地下钢铁管道连接镁块,形成镁铁原电池,故D错误;
故选B.
点评 本题考查了原电池的构成条件,注意这几个条件必须同时具备,缺一不可,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.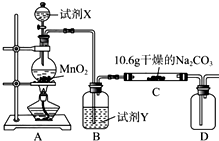 某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
(1)装置A中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)装置B中试剂Y应为饱和食盐水.
(3)该实验装置中明显存在不足之处,改进的措施为在装置D后连接一尾气处理装置.
(4)已知在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物).C中含氯元素的盐只有一种,且含有NaHCO3.现对C中的成分进行猜想和探究.
①提出合理假设.
假设一:存在两种成分,为NaHCO3和NaCl;
假设二:存在三种成分,为NaHCO3和NaCl、Na2CO3.
②设计方案并实验.请在表格中写出实验步骤以及预期现象和结论.
限选试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
结论:由步骤3的结论结合步骤2中的a,则假设一成立;由步骤3的结论结合步骤2中的b,则假设二成立.
(5)已知C中有0.1mol Cl2参加反应.若假设一成立,可推知C中反应生成的含氯氧化物为Cl2O(写化学式).
 某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.(1)装置A中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)装置B中试剂Y应为饱和食盐水.
(3)该实验装置中明显存在不足之处,改进的措施为在装置D后连接一尾气处理装置.
(4)已知在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物).C中含氯元素的盐只有一种,且含有NaHCO3.现对C中的成分进行猜想和探究.
①提出合理假设.
假设一:存在两种成分,为NaHCO3和NaCl;
假设二:存在三种成分,为NaHCO3和NaCl、Na2CO3.
②设计方案并实验.请在表格中写出实验步骤以及预期现象和结论.
限选试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
结论:由步骤3的结论结合步骤2中的a,则假设一成立;由步骤3的结论结合步骤2中的b,则假设二成立.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a.a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液(填写所加试剂即可) | b.若溶液变浑浊,证明固体中含有NaCl |
11.下列说法中,不正确的是( )
| A. | 电解质的电离,既是化学过程,也是化学反应 | |
| B. | 即使没有发生化学变化,也可能有能量的变化 | |
| C. | 化学反应中既有物质变化又有能量变化 | |
| D. | 物质的化学能可以通过不同的变化方式转化为热能、电能等 |
18.一定量混合气体在密闭容器中发生如下反应:x A(g)+y B(g)?z C(g),该反应达到平衡后,测得C气体的浓度为0.5mol/L.在恒温下将密闭容器体积压缩到原来的一半,再次达到平衡后,测得C的浓度为0.8mol/L,则下列叙述不正确的是( )
| A. | 平衡向逆反应方向移动 | B. | B的转化率提高 | ||
| C. | C的体积分数降低 | D. | x+y<z |
8.某温度下,在定容的密闭容器中,建立了如下平衡:2NO2(g)?N2O4(g),若再向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内NO2气体质量分数比原平衡时( )
| A. | 都增大 | B. | 前者增大,后者减小 | ||
| C. | 都减小 | D. | 前者减小,后者增大 |
12.氯水中有Cl2、HCl、HClO,其中含量最多的是( )
| A. | HCl | B. | HClO | C. | Cl2 | D. | 不能确定 |
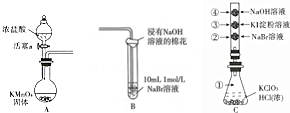
 ,浸有氢氧化钠溶液的棉花的作用是吸收多余的氯气,防止污染环境
,浸有氢氧化钠溶液的棉花的作用是吸收多余的氯气,防止污染环境