题目内容
5.用NA代表阿伏加德罗常数的值,下列有关说法正确的是( )| A. | 钠在氧气中燃烧,1 mol O2作氧化剂时得到的电子数为4NA | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 标准状况下,22.4LCCl4所含有的原子数目为5NA | |
| D. | 1mol Na2O2与足量H2O反应,转移的电子数为NA |
分析 A、钠在氧气中燃烧时,氧元素的化合价由0价变为-1价;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、标况下四氯化碳为液态;
D、过氧化钠与水的反应为歧化反应.
解答 解:A、钠在氧气中燃烧时,氧元素的化合价由0价变为-1价,故1mol氧气得到2mol电子即2NA个,故A错误;
B、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L氦气的物质的量小于1mol,而氦气为单原子分子,则含有的原子小于NA个,故B错误;
C、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、过氧化钠与水的反应为歧化反应,1mol过氧化钠转移1mol电子即NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.2009年8月15日~12月15日,公安部在全国开展为期四个月的严厉整治酒后驾驶交通违法行为专项行动,在执法中,交警用装有重铬酸钾[K2Cr2O7]的仪器检测司机是否酒后开车,因为酒中的乙醇分子可以使橙红色的重铬酸钾变成绿色的硫酸铬[Cr2(SO4)3].下列有关重铬酸钾的说法中正确的是( )
| A. | 铬元素的化合价为+7价 | B. | 在检查时重铬酸钾发生氧化反应 | ||
| C. | 重铬酸钾具有强氧化性 | D. | 它由橙红色变为绿色是物理变化 |
16.用NA表示阿伏加德罗常数的值.下列叙述正确的是(相对原子质量:C 12 H 1 O 16 )( )
| A. | 标准状况下,22.4L乙醇中含有的碳原子数目为2NA | |
| B. | 78g 苯含有碳碳双键的数目为3NA | |
| C. | 1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA | |
| D. | 28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
13.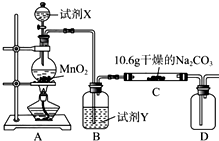 某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
(1)装置A中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)装置B中试剂Y应为饱和食盐水.
(3)该实验装置中明显存在不足之处,改进的措施为在装置D后连接一尾气处理装置.
(4)已知在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物).C中含氯元素的盐只有一种,且含有NaHCO3.现对C中的成分进行猜想和探究.
①提出合理假设.
假设一:存在两种成分,为NaHCO3和NaCl;
假设二:存在三种成分,为NaHCO3和NaCl、Na2CO3.
②设计方案并实验.请在表格中写出实验步骤以及预期现象和结论.
限选试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
结论:由步骤3的结论结合步骤2中的a,则假设一成立;由步骤3的结论结合步骤2中的b,则假设二成立.
(5)已知C中有0.1mol Cl2参加反应.若假设一成立,可推知C中反应生成的含氯氧化物为Cl2O(写化学式).
 某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.(1)装置A中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)装置B中试剂Y应为饱和食盐水.
(3)该实验装置中明显存在不足之处,改进的措施为在装置D后连接一尾气处理装置.
(4)已知在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物).C中含氯元素的盐只有一种,且含有NaHCO3.现对C中的成分进行猜想和探究.
①提出合理假设.
假设一:存在两种成分,为NaHCO3和NaCl;
假设二:存在三种成分,为NaHCO3和NaCl、Na2CO3.
②设计方案并实验.请在表格中写出实验步骤以及预期现象和结论.
限选试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
结论:由步骤3的结论结合步骤2中的a,则假设一成立;由步骤3的结论结合步骤2中的b,则假设二成立.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a.a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液(填写所加试剂即可) | b.若溶液变浑浊,证明固体中含有NaCl |
20.下列说法正确的是( )
| A. | 0.5molH2所占的体积约为11.2L | |
| B. | 标准状况下,6.02×1023个分子所占的体积约是22.4L | |
| C. | H2的摩尔质量为2g•mo l-1 | |
| D. | 阿伏伽德罗常数就是6.02×1023,没有单位 |
10.某无土栽培用的营养液要求KCl、K2SO4、NH4Cl三种固体原料的物质的量之比为1:4:8,若用696g K2SO4配成1L营养液,关于该营养液的说法正确的是( )
| A. | 所需KCl和NH4Cl的质量分别为:74.5g和428g | |
| B. | 所配营养液K+的物质的量浓度为8 mol/L | |
| C. | 若用1000mL的容量瓶配制,定容时俯视刻度线,所配营养液浓度偏低 | |
| D. | 所用的容量瓶除检查是否漏水外,容量瓶要保持干燥 |
17.为了达到下表中所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其标号填入对应的空格中.
供选择的化学试剂:
A.新制氢氧化铜悬浊液 B.硝酸银溶液和硝酸
C.碘水 D.无水硫酸铜粉末.
| 实验要求 | 化学试剂 |
| 检验酒精中是否有水 | D |
| 区别蔗糖和葡萄糖 | A |
| 证明地瓜中有淀粉 | C |
| 证明味精中有NaCl | B |
A.新制氢氧化铜悬浊液 B.硝酸银溶液和硝酸
C.碘水 D.无水硫酸铜粉末.