题目内容
5.用如图所示的A、B、C三种装置都可制取溴苯,请仔细分析三套装置,回答下列问题:
(1)写出三个装置中都发生的反应的化学方程式
 .
.(2)装置A、C中长导管的作用是导气(导出HBr)兼冷凝(冷凝苯和溴蒸气).
(3)将B装置连接好,检验气密性,再装入合适的药品,接下来要使反应开始,对B装置应进行的操作是打开分液漏斗上端塞子,旋转分液漏斗活塞,使Br2和苯的混合液滴到铁粉上.
(4)B中采用了双球吸收管,其作用是吸收反应中随HBr逸出的溴和苯的蒸气,反应后双球管中可能出现的现象是CCl4由无色变橙色.
(5)A中存在加装药品和及时密闭的矛盾,因而在实验中易造成的不良后果是Br2和苯的蒸气逸出,污染环境.
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行,这两个缺点是原料利用率低;容易产生倒吸.
分析 (1)A、B、C三种装置都可制取溴苯,都会发生铁与溴的反应、苯与溴的取代反应;未被吸收的HBr进入硝酸银溶液,与硝酸银反应生成溴化银反应生成浅黄色溴化银沉淀;
(2)苯和溴易挥发,长导管能导气及回流冷凝作用;
(3)根据对B、C应进行的操作目的是使Br2和苯与催化剂接触来分析;
(4)双球吸收关吸收了溴和苯;反应后双球吸管中四氯化碳吸收了溴;
(5)苯和溴易挥发,并且有毒,苯与溴逸入空气会造成环境污染;
(6)随HBr逸出的溴蒸气和苯蒸气不能回流到反应器中,原料利用率低,由于导管插入AgNO3溶液中而容易产生倒吸.
解答 解:(1)A、B、C三种装置都可制取溴苯,三个装置中都发生都会发生铁与溴的反应、苯与溴的取代反应,反应的化学方程式为2Fe+3Br2=2FeBr3, ;HBr与硝酸银反应生成溴化银反应生成浅黄色溴化银沉淀,方程式为:HBr+AgNO3=AgBr↓+HNO3,三个装置中都发生的反应的化学方程式
;HBr与硝酸银反应生成溴化银反应生成浅黄色溴化银沉淀,方程式为:HBr+AgNO3=AgBr↓+HNO3,三个装置中都发生的反应的化学方程式 ,
,
故答案为: ;
;
(2)苯和溴的取代反应中有溴化氢生成,苯和溴易挥发,所以导管b除导气外,还有起冷凝回流作用,减少苯和溴的挥发,
故答案为:导气(导出HBr)兼冷凝(冷凝苯和溴蒸气);
(3)苯和溴反应较慢,为加快反应速率,常常加入催化剂;催化剂只有和反应混合时才起作用,所以对B应进行的操作是打开分液漏斗上端塞子,旋转分液漏斗活塞,使Br2和苯的混合液滴到铁粉上;
故答案为:打开分液漏斗上端塞子,旋转分液漏斗活塞,使Br2和苯的混合液滴到铁粉上;
(4)B装置中采用了双球吸收管,利用四氯化碳吸收反应中随HBr逸出的溴和苯的蒸气;反应后双球吸管中四氯化碳吸收了溴单质,溶液从无色变成了橙色,
故答案为:吸收反应中随HBr逸出的溴和苯的蒸气,CCl4由无色变橙色;
(5)苯和溴易挥发,并且有毒,苯与溴逸入空气会造成环境污染,
故答案为:Br2和苯的蒸气逸出,污染环境;
(6)随HBr逸出的溴蒸气和苯蒸气不能回流到反应器中,原料利用率低;由于导管插入AgNO3溶液中而容易产生倒吸,
故答案为:原料利用率低;容易产生倒吸.
点评 本题考查了苯的取代反应实验,考查的知识点有化学反应方程式的书写、催化剂的作用、产物的判断等,考查学生对该知识的总结、应用能力,题目难度中等.


| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
| A. | 1L1mol•L-1的Na2CO3溶液中含有CO32-的数目为NA | |
| B. | 28g的乙烯和丙烯中含碳原子数目为NA | |
| C. | 标准状况下,6.72LNO2与水充分反应转移的电子数目为0.1NA | |
| D. | 常温常压下,14g由N2与CO组成混合气体含有的原子数目为NA |
| 容器编号 | 起始时各种物质的量/mol | 达到平衡时体系能量的变化 | |||
| n(A) | n(B) | n(C) | n(D) | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
| ② | 0 | 0 | 1 | 4 | 放出热量:Q1 |
| ③ | 1 | 1 | 2 | 1 | 放出热量:Q2 |
| A. | 若容器①中反应10min达到平衡,0~10min时间内,用A表示的平均反应速率v(A)=4.0×10-2mol/(L•min) | |
| B. | 平衡时,①与②容器中A的体积分数相等 | |
| C. | ③达平衡时体系能量的变化主要为热能转化为化学能 | |
| D. | 容器③中,开始时v(B)生成>v(B)消耗 |
 二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.(1)二氧化碳重整可用于制取甲烷.已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247kJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205kJ•mol-1
则反应CO2(g)+4H2(g)?CH4(g)+2H2(g)的△H3-163kJ/mol.
(2)一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
①降低温度,平衡向正反应方向移动.
②在700K、起始投料比n(H2)n(CO2)=1.5时,H2的转化率为40%.若达到平衡后H2的浓度为amol•L-1,则达到平衡时CH2CH2OH的浓度为a9mol/L.
(3)CO2和H2在一定条件下可合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+2H2O(g)△H.在一定压强下,将2.5molH2与amolCO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据如下表:
| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应的叙述正确的是ABC.
A.该反应的△H<0,△S<0 B.该反应的平衡常数随温度升高而减小
C.转化率分别为z、w时,达到平衡的时间前者长 D.转化率分别为y、w时,平衡常数不同.
| A. | 18 g | B. | 18 g.•mol-1 | C. | 36 g | D. | 36 g•mol-l |

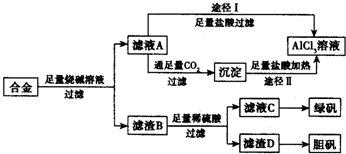 工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O) 和胆矾晶体(CuSO4•5H2O)设计了如下方案如图所示:请回答相关问题:
工业上用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O) 和胆矾晶体(CuSO4•5H2O)设计了如下方案如图所示:请回答相关问题: